- English
- 日本語
- 한국어
- Deutsch
- Français
- Español
No data
官方服务号
招聘公众号




将E18大鼠胚胎来源的海马神经元接种于NeoBento™的培养通道1(Culture Channel 1),皮层神经元接种于培养通道3(Culture Channel 3),构建体外共培养体系。通道预先包被聚-D-赖氨酸(PDL)与层粘连蛋白(laminin),以促进神经元的黏附、生长及神经网络的逐步成熟。培养过程为期21天,期间每周更换培养基三次,以维持适宜的生长环境。
为评估神经元的状态和成熟度,使用β-III-微管蛋白(β-III-tubulin)和DAPI对细胞形态进行可视化染色,并使用MAP2对神经元树突进行标记,以评价其成熟情况。同时,在第7、14和21天使用MEA进行电生理记录,测量神经元自发放电活动。
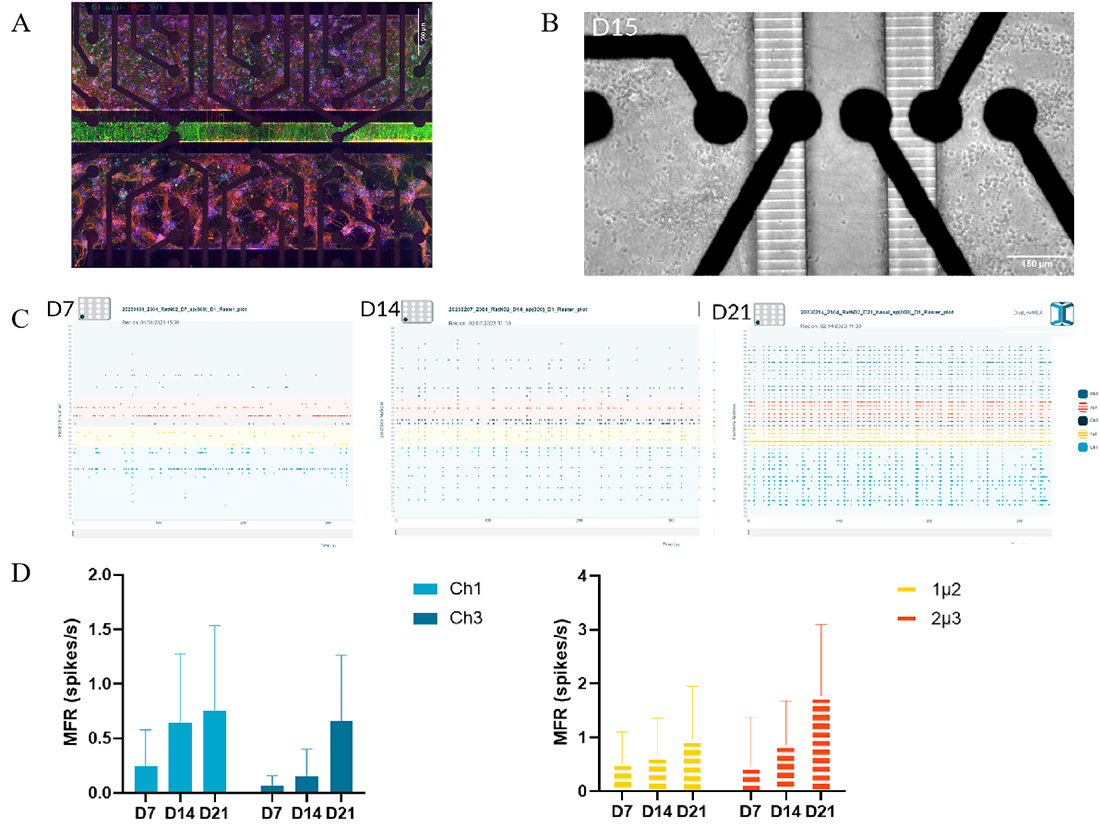
A. 大鼠海马神经元(Culture Channel 1)和皮质神经元(Culture Channel 3)的免疫荧光染色图。结果显示,神经元成功附着于培养通道,并能够延伸出轴突。DAPI标记细胞核(蓝色),β-III-微管蛋白标记胞体与轴突(绿色),MAP2标记树突(红色),比例尺500µm
B. 第15天大鼠神经元共培养体系的明场图,可见神经元轴突明显延伸
C. 第7、14和21天共培养体系的光栅图(记录时长为300秒)。神经网络自第14天起出现同步化放电活动,并在第21天达到更显著的同步水平,表明网络功能的逐步成熟
D. 第7、14和21天共培养体系中,培养通道与连接微通道的平均放电频率(MFR)对比。结果显示,MFR随培养时间显著上升。第14天时,连接微通道中已检测到较高的自发性电活动(0.8 spikes/s),而培养通道中的MFR为0.3 spikes/s,表明连接微通道内轴突通路的功能发育可能更快