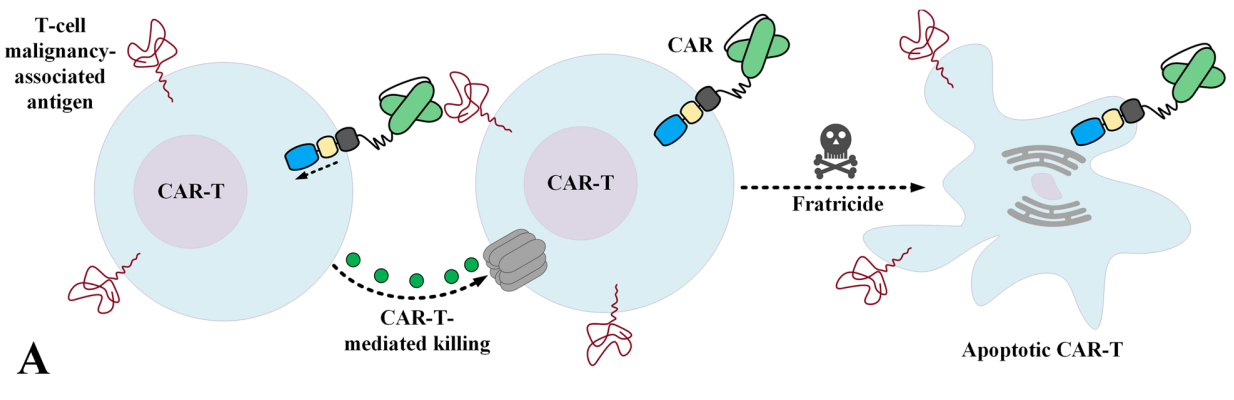
嵌合抗原受体T细胞(CAR-T)疗法在治疗各种类型的复发性/难治性(R/R)B细胞恶性肿瘤包括弥漫大B细胞淋巴瘤(DLBCL)、急性B细胞淋巴白血病(B-ALL)和多发性骨髓瘤(MM)的治疗中得到广泛应用并取得良好的临床效果。然而,CAR-T疗法在治疗T细胞恶性肿瘤中却面临着诸多挑战。第一个困难是缺乏T细胞肿瘤特异性靶向抗原,由于T细胞肿瘤靶向抗原如CD5、CD7在大多数正常T细胞中也表达,因此CAR细胞会杀伤正常T细胞而导致T细胞再生障碍,如果不加以控制或预防,T细胞再生障碍可能会危及生命;此外,CAR-T细胞也是一种T细胞,在细胞膜表面同样表达靶向抗原,这一特征使免疫细胞和肿瘤细胞拥有相同的靶点致使CAR-T细胞产生“自相残杀”的现象,即CAR-T细胞相互攻击并消灭对方。本文结合T细胞淋巴瘤相关靶点抗原,浅析针对上述问题的一些对应策略,阐述CAR细胞疗法治疗T细胞恶性肿瘤成为可能的相关要点。
CRISPR-Cas9技术精确修饰相关TCR和抗原
CD7是一种来自Ig超家族的跨膜糖蛋白,通常在NK细胞和T淋巴细胞上表达,在急性T细胞淋巴白血病(T-ALL)以及其他T细胞恶性肿瘤中高度表达,是T细胞癌症免疫治疗的潜在靶点。然而,靶向CD7的CAR-T细胞生产一直存在问题,CD7 CAR-T细胞不仅会杀伤CD7高表达的肿瘤细胞,亦会“误杀”同样表达CD7的CAR-T细胞同类,这一结果导致CAR-T细胞被快速清除使CD7 CAR-T细胞扩增数量大幅降低。为解决这一问题,研究人员使用CRISPR-Cas9基因组编辑工具在T细胞中破坏CD7表达,然后将其改造成CAR-T细胞,结果表明这种方法不仅对CAR-T细胞的肿瘤杀伤力没有造成任何负面影响,而且还大幅度提高了它们的扩增效率。另外,也有课题组利用CRISPR-Cas9同时对T细胞的TCR和CD7分子进行敲除,其中,TCR的敲除能够避免CAR-T细胞用于异体治疗时引起的移植物抗宿主病(GVHD)风险,CD7的敲除使CAR-T细胞能够避免互相残杀。在该项研究中,CD7 CAR-T细胞在多种CD7白血病细胞株和肿瘤动物模型中均表现出了良好的抗肿瘤活性,同时并未引起GVHD反应。因此,该项CD7 CAR-T细胞的开发对复发难治性急性T淋巴细胞白血病(R/R T-ALL)以及非霍奇金T细胞淋巴瘤(T-NHL)的治疗具有重大意义。
相关临床前研究表明,CD4 CAR-T细胞对T细胞恶性肿瘤杀伤具有优异活性。一款CD8+细胞毒性T细胞来源的第三代CD4 CAR-T细胞疗法,对表达CD4的细胞株和来源于外周T细胞淋巴瘤(PTCL)患者细胞样本都显示出抗肿瘤活性,同时保留其记忆干细胞样表型,同时,为评价CD4 CAR-T细胞的体内抗肿瘤活性,利用Karpas 299细胞系建立了临床前小鼠模型,试验证明CD4 CAR-T细胞也表现出抗肿瘤活性,保护小鼠免受癌细胞的攻击。然而有些研究人员认为CD4 CAR-T在治疗T细胞恶性肿瘤中存在一些问题,原因是治疗过程中根除正常的CD4+T细胞会导致T细胞再生障碍和随之而来的免疫缺陷病毒/获得性免疫缺陷综合症(HIV/AIDS)。但随着研究不断深入,科学家使用alemtuzumab(CD52单抗)作为天然安全开关,在临床前模型中预防T细胞再生障碍,关于CD4 CAR-T细胞疗法针对T细胞恶性肿瘤的安全性和有效性还在进一步研究中。
CD5在大约85%的T细胞恶性肿瘤中高度表达,同时CD5在人胸腺细胞、外周T淋巴细胞和B淋巴细胞亚群中B-1a细胞中正常表达。基于对CD5在不同类型T细胞恶性肿瘤患者的相关研究,显示CD5靶点可适合于一些T细胞恶性肿瘤的免疫治疗。有研究人员使用CD5 CAR-T细胞4-1BB共刺激结构域取代CD28促进中枢记忆分化,尽管增强了CAR-T细胞抗肿瘤活性,但与携带CD28共刺激结构域的CD5 CAR-T细胞相比,这些CAR-T细胞自相残杀水平却明显提高,扩增能力大幅下降。随后,开发了一种能够调节 CAR 表达的Tet-Off系统,通过以可逆的方式控制CAR表达,避免T细胞自相残杀和靶抗原衰竭。该系统能够在体外使用强力霉素时可逆地抑制CAR表达,而在不给药的情况下,CAR表达可以恢复,因此,配备Tet-Off系统的CD5 CAR-T细胞表现出更好和更持久的肿瘤抑制作用。
为支持T细胞淋巴瘤相关研究,ACROBiosystems百普赛斯作为专注于医药研发领域的蛋白供应商,利用专业的蛋白研发平台、蛋白标记平台、流式细胞分析平台,开发了一系列包括非标记、生物素标记、荧光标记等多种形式的T细胞淋巴瘤靶点蛋白,可用于免疫筛选、CAR表达质控以及临床PK研究,加速T细胞淋巴瘤CAR细胞药物的研发进程。
★ 高生物活性经ELISA、SPR、FACS等验证
★ 部分产品已完成FDA DMF备案,加速临床/上市申报
★ 免费提供Protocol,提供专业的技术支持
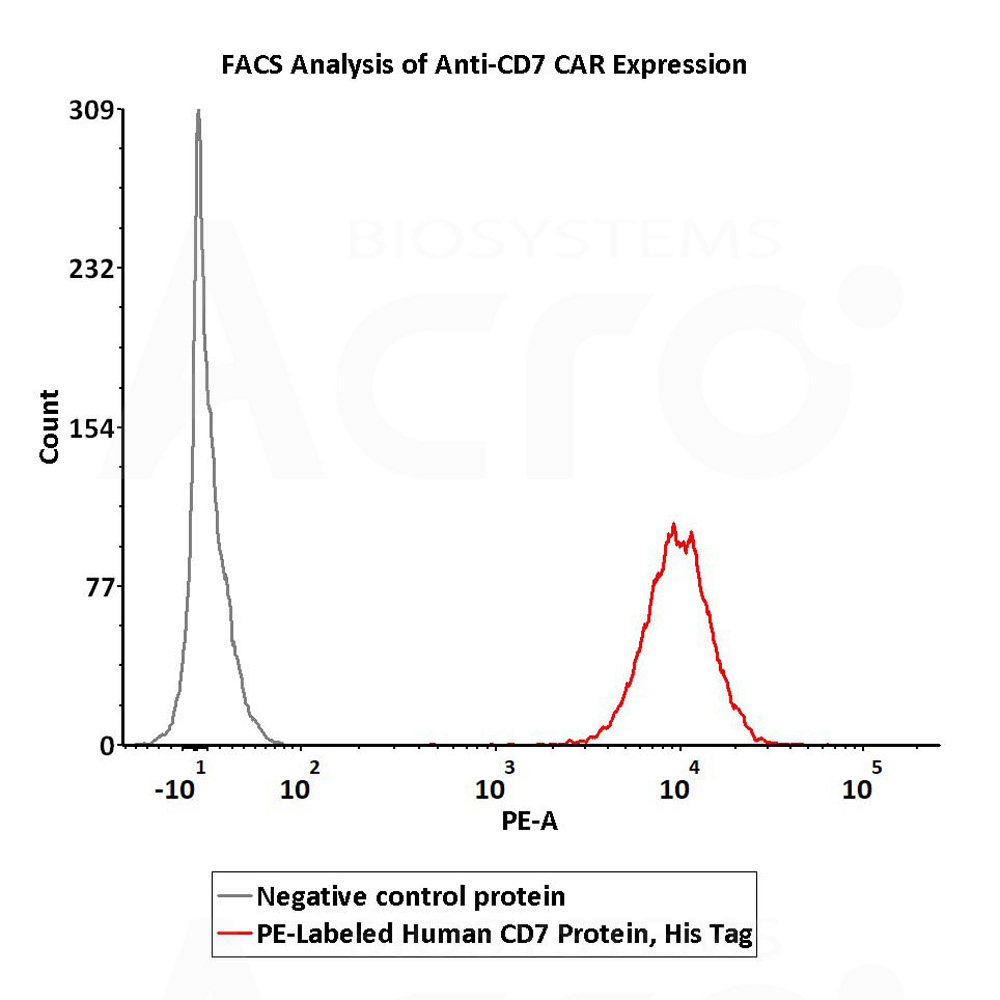
5e5 of anti-CD7 CAR-293 cells were stained with 100 μL of 1:50 dilution (2 μL stock solution in 100 μL FACS buffer) of PE-Labeled Human CD7 Protein, His Tag(Cat. No. CD7-HP2E3) and negative control protein respectively. PE signal was used to evaluate the binding activity (QC tested).
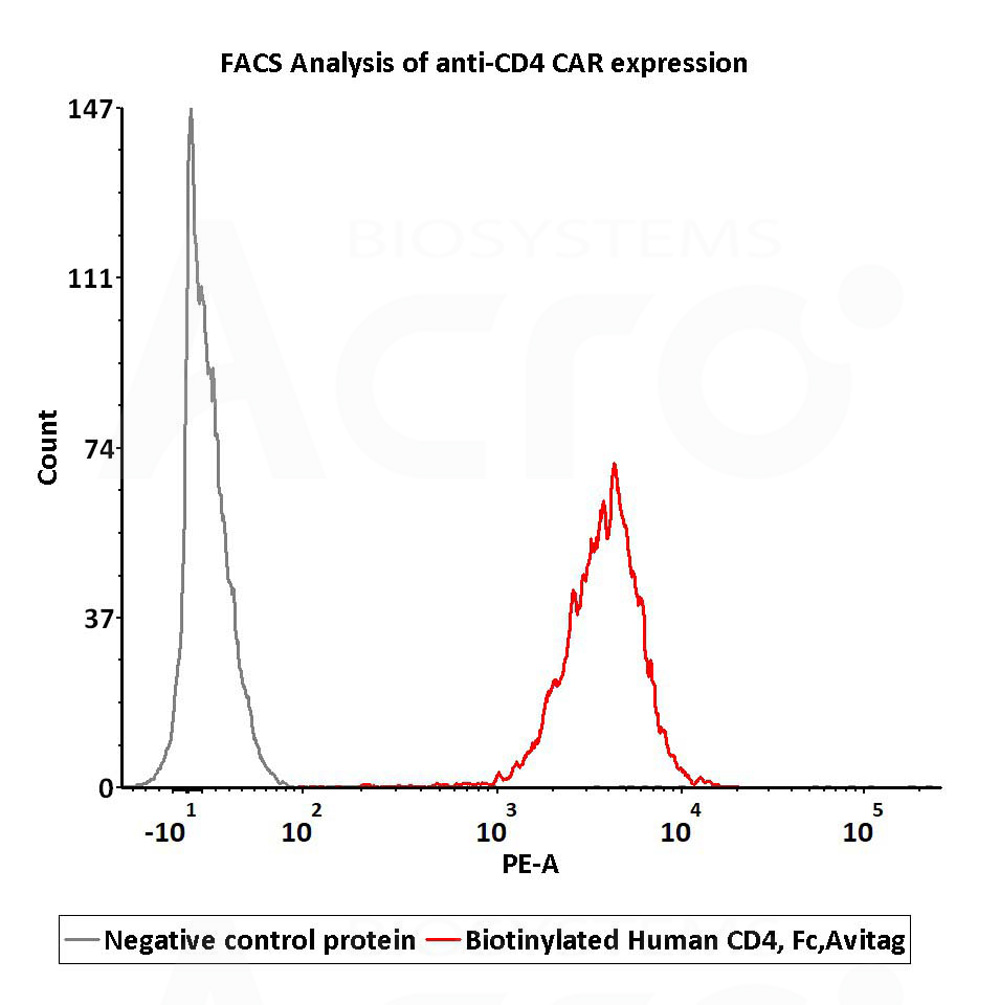
2e5 of anti-CD4 CAR-293 cells were stained with 100 μL of 1 μg/mL of Biotinylated Human CD4, Fc,Avitag (Cat. No. CD4-H82F3) and negative control protein respectively, washed and then followed by PE-SA and analyzed with FACS (Routinely tested).
参考文献
1. Safarzadeh Kozani P, Safarzadeh Kozani P, Rahbarizadeh F. CAR-T cell therapy in T-cell malignancies: Is success a low-hanging fruit? Stem Cell Res Ther. 2021 Oct 7;12(1):527. doi: 10.1186/s13287-021-02595-0. PMID: 34620233; PMCID: PMC8499460.
2. Xie L, Ma L, Liu S, Chang L, Wen F. Chimeric antigen receptor T cells targeting CD7 in a child with high-risk T-cell acute lymphoblastic leukemia. Int Immunopharmacol. 2021 Jul;96:107731. doi: 10.1016/j.intimp.2021.107731. Epub 2021 May 6. PMID: 33965880.






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining