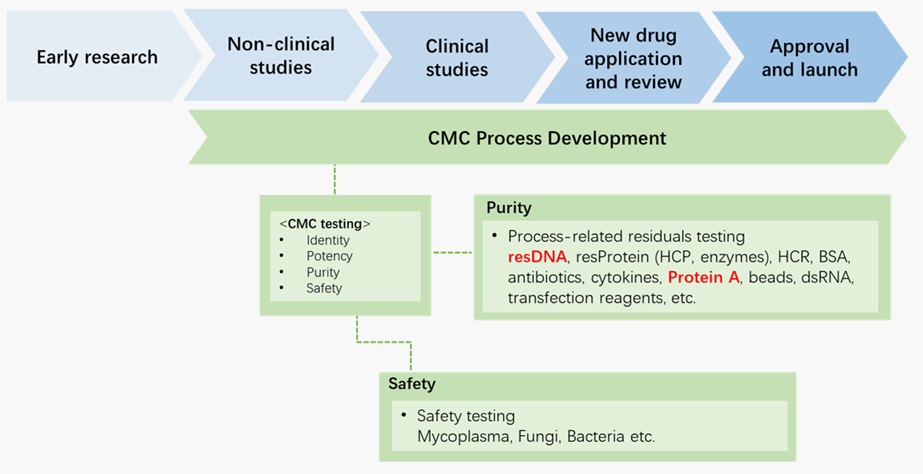
宿主细胞是生物制品研发与生产的基石,被广泛应用于各类生物制品的研发与生产当中,包括单克隆抗体药物、重组蛋白药物、CGT药物及疫苗等。残留宿主细胞DNA(Host cell DNA/residual DNA, resDNA)是指可能出现于生物制品中的来自宿主细胞的DNA片段或更长的分子。自20世纪80年代以来,研究者提出一系列resDNA的潜在安全问题,特别是resDNA潜在的致癌风险及感染性等。随着生物制品行业的快速发展及越来越广泛的应用,为了确保相关产品的安全性和效力,各国药品监督管理机构均对生物制品中宿主细胞DNA的残留量进行了严格的限度控制。<<<点击了解残留宿主细胞DNA检测试剂盒
治疗载体作为细胞与基因治疗产品的重要生产要素,被广泛用于细胞与基因治疗产品开发中。在病毒载体生产环节中,不可避免的会使用携带了致瘤基因、病毒来源序列的细胞系进行生产,这些宿主细胞DNA和风险元件DNA最终可能会残留到治疗载体中。根据FDA化学、制造和控制(CMC)指南要求,特别是基于细胞的基因疗法,这些残留DNA必须在质量研究和质量控制环节中进行检测,以确保治疗产品的安全性和纯度;CDE《体外基因修饰系统药学研究与评价技术指导原则(试行)》中《质量研究》提到:“对产品中已知具有安全性风险的特定转化序列的残留,如 E1A、SV40大T抗原等应分别进行控制”。 <<<点击了解HEK293及风险元件残留检测试剂盒
亲和层析 (AC) 已被广泛用于生物药生产工艺,被认为是各种类型生物药下游纯化工艺中初步捕获的首选方法,如在治疗性抗体生产中,主要使用Protein A 填料作为捕获填料进行抗体纯化。但当使用Protein A亲和层析进行抗体纯化时,Protein A有一定概率可与抗体同时从填料中析出,尤其是当色谱柱循环使用老化时,更容易脱落Protein A导致抗体污染,这将对抗体药物的安全性和有效性造成潜在的隐患。因此,对使用Protein A亲和层析填料纯化出的抗体制剂中残留Protein A的检测,是抗体药物制剂生产过程中关键的质量控制步骤,同时,国内外药品监管机构发布了相关技术要求文件,为抗体药物的研发和生产提供参考。<<<点击了解Universal Protein A Quick ELISA kit
在免疫细胞治疗产品的生产过程中,培养基补充剂如IL-2、IL-15、IL-7以及IL-21等细胞因子是TNK等免疫细胞增殖分化的主要试剂,是免疫细胞治疗药物生产的关键原材料(Ancillary Materials, AM)。对于这些关键原料,相关法规/指导原则除了对其质量提出建议要求外,(如USP<1043> “辅助材料应进行全面鉴定/表征:来源、鉴别、纯度、功能,生物安全(无微生物、病毒)等),其在工艺中的残留也需要评估和控制:USP<1043> “开发人员应在开发早期建立AM去除的程序和分析方法,开发适当的残留检测方法可确保CGT 产品和工艺的一致性,对最终CGT产品进行表征,并减少对产品质量、临床疗效和安全性的负面影响”<<<点击了解细胞培养原料残留检测试剂盒
在相关药物的生产工艺中,需要对如全能核酸酶残留、CRISPR/Cas蛋白残留、抗生素残留、mRNA原料酶残留等进行监测分析,以确保最终产品的质量和安全,它们是衡量生物制品质量的重要指标之一。
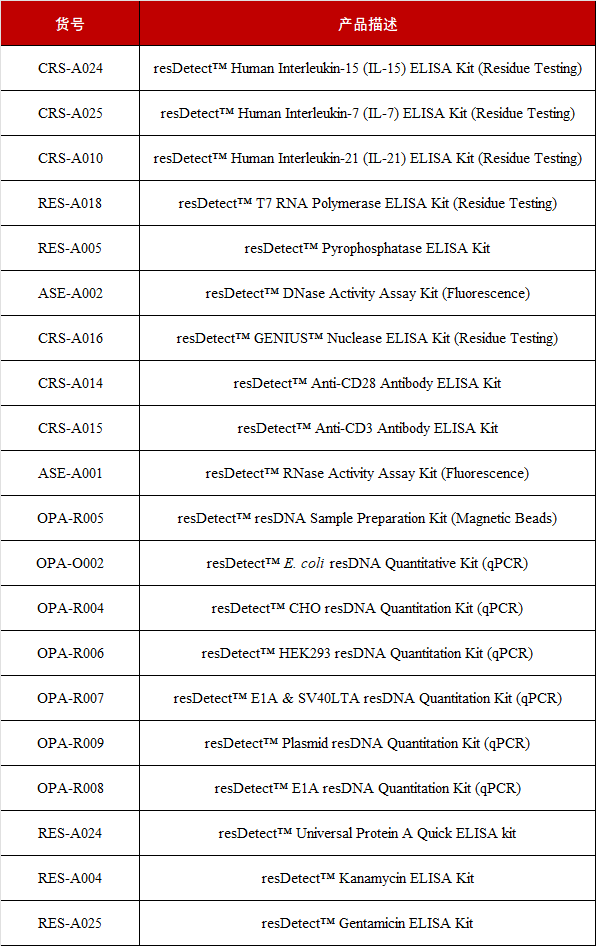
基于此,为更好的支持生物药CMC生产工艺和质量研究,ACROBiosystems百普赛斯基于各国生物药物工艺残留检测的法律法规和国际组织的指导方针,开发了一系列生物药(抗体药、CGT、疫苗等)工艺相关应用场景的resDetectTM残留检测试剂盒和工艺残留检测整体解决方案, resDetectTM包括Host cell DNA、Host cell protein、Host cell RNA、Protein A、Tool enzymes、Cytokines等残留检测试剂盒产品,全面助力药物研发上市进程!
● 稳定可靠——严格批检放行,批间差异小于15%;● 验证充分——参考ICH Q2 (R2) 和ChP 9101等指导原则;





















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining