随着人类医学技术的不断提升,当代医学领域正发生着快速的改变,逐渐从分子治疗迈入细胞治疗。细胞治疗是利用患者自体(或异体)的成体细胞(或干细胞)对组织、器官进行修复的治疗方法。广泛用于骨髓移植、晚期肝硬化、股骨头坏死、恶性肿瘤、心肌梗死等疾病。
根据国家药监局今年2月发布的《免疫细胞治疗产品临床试验技术指导原则(试行)》,目前的细胞免疫治疗研究类型主要包括:肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)、嵌合抗原受体T细胞(chimeric antigen receptor modified T cells, CAR-T)以及工程化T细胞受体修饰的T细胞(T-cell receptor-engineered T cells, TCR-T)等,此外,还存在基于自然杀伤细胞(natural killer cells, NK)或树突状细胞(dendritic cells, DC)等其它免疫细胞的治疗方法,如细胞因子诱导的杀伤细胞(cytokine-induced killer cells, CIK)等;
其中最为火热的无疑是CAR-T疗法,紧随其后的则是TCR-T。除了针对T细胞之外,小编在文中会为您介绍其中两种“网红”细胞治疗的研发路线。
树突状细胞(dendritic cell, DC)是人体中重要的一类免疫细胞,是目前已知的功能最强的抗原递呈细胞(antigen presenting cells, APC)。它能高效地摄取、加工处理和递呈抗原,未成熟DC细胞具有较强的迁移能力,成熟DC细胞能有效激活初始T细胞,处于启动、调控、并维持免疫应答的中心环节,是惟一能激活未致敏的初始型T细胞的APC。同时,DC细胞能参与B细胞的激活及分泌多种细胞因子,参与免疫调节。
因DC细胞是人体内已知的最强抗原提呈细胞,能够刺激初始T细胞进行增殖。DC疗法就是将肿瘤细胞的DNA、RNA、肿瘤细胞裂解物、肿瘤抗原蛋白/多肽等致敏DC细胞,利用DC细胞强大的抗原呈递功能,激活T细胞免疫应答。DC细胞疗法不仅在治疗方面发挥作用,还可以起到预防的作用,又称为DC疫苗。目前全球范围内已有4款DC疫苗获批上市,均为DC肿瘤疫苗。
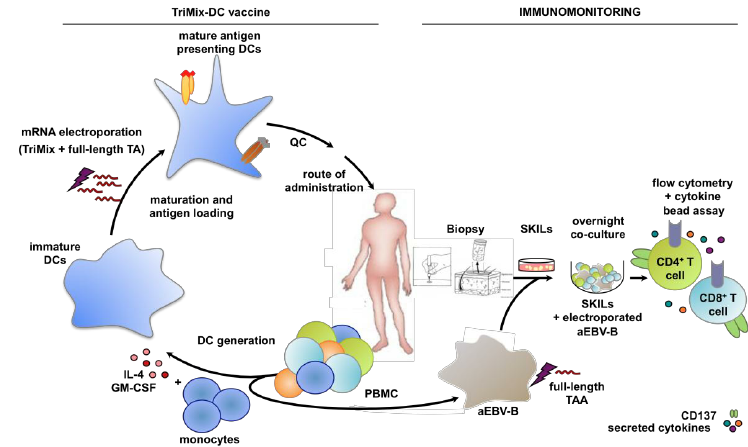
来源:Overview of TriMix-DC therapy and its immunologic evaluation.
肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)同时具有肿瘤杀伤作用及促肿瘤作用。M1型巨噬细胞被TLR或Th1细胞因子激活,具有很高的抗原呈递能力的同时,还分泌活性氧(ROS)及促炎性细胞因子,与癌症良好预后相关。相反,M2型巨噬细胞被Th2衍生的细胞因子极化,促进组织修复。同时,M2型巨噬细胞可通过分泌肾上腺髓质素和血管上皮生长因子(VEGF)支持血管生成并表达免疫抑制分子,从而促进肿瘤生长。
巨噬细胞是身体对病毒感染的第一反应者,同时巨噬细胞也是体内最专业的“清除者”,在免疫中通过择性地吞噬,从而起到保护机体的作用,可以直接起到对肿瘤的杀伤作用,因此CAR-M被认为是细胞治疗的重要方向。然而,由于巨噬细胞不易被基因疗法和细胞疗法中使用的标准病毒载体转染,导致通过基因改造细胞攻击癌症的尝试止步不前。2021年3月18日,美国Carisma Therapeutics公司(以下简称为Carisma)宣布完成首例靶向Her2的CAR-M疗法(CT-0508)受试者给药,标志着CAR-M改造治疗实体瘤进入新纪元。
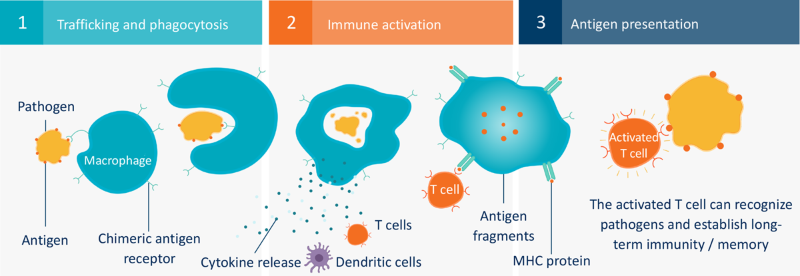
来源:The unique mechanism of action of chimeric antigen receptor macrophage (CAR-M) therapies. MHC, major histocompatibility complex.
无论是DC还是CAR-M细胞疗法,都要经历从病人体内分离细胞,然后DC细胞或巨噬细胞在体外进行改造,再扩大培养,最终输回体内的过程。比较常用的方法是在人PBMC中分选出单核细胞,在利用IL-4和GM-SCF诱导分化成DC细胞或巨噬细胞。将单核细胞诱导分化为未成熟的DC细胞(Immature DC)需要细胞因子IL-4和GM-CSF。将未成熟的DC细胞诱导分化成成熟的DC细胞(Mature DC)需要TNF-α,IL-6,IL-1 beta,将单核细胞诱导分化为巨噬细胞需要细胞因子GM-CSF,因此,IL-4、GM-CSF、TNF-alpha、IL-6、IL-1 beta在DC和CAR-M细胞治疗中必不可少。
ACROBiosystems特推出IL-4、GM-CSF、TNF-alpha、IL-6、IL-1 beta相关产品。产品具有以下特点:
点击图片查看产品详细信息
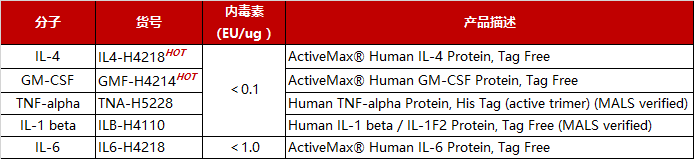

The purity of Human IL-1 beta, Tag Free (Cat. No. ILB-H4110) was more than 95% and the molecular weight of this protein is around 15-23 kDa verified by SEC-MALS.
高生物活性经Cell based assay & SPR & BLI验证

ActiveMax® Human IL-4, Tag Free (Cat. No. IL4-H4218) stimulates the proliferation of TF-1 human erythroleukemic cells. The ED50 for this effect is 0.27-0.49 ng/mL (Routinely tested).
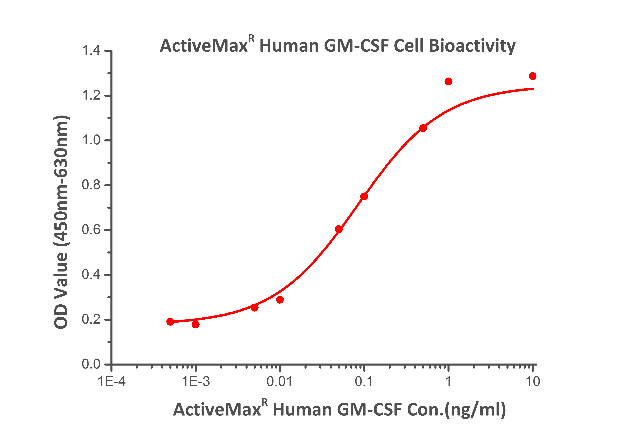
The bioactivity of ActiveMax Human GM-CSF Protein, Tag Free (Cat. No.GMF-H4214) was determined by dose-dependent stimulation of the proliferation of TF-1 cells. The ED50 < 0.1 ng/mL, corresponding to a specific activity of > 1x107 Unit/mg.
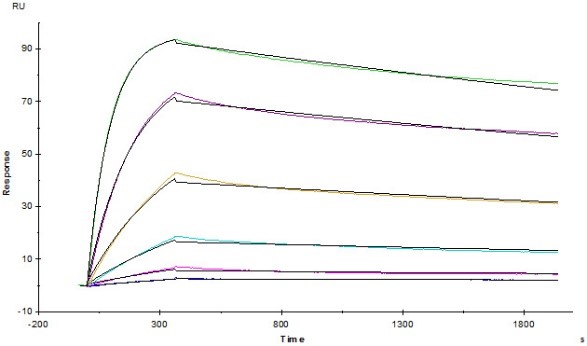
Humira (Adalimumab) captured on CM5 chip via anti-human IgG Fc antibodies surface, can bind Human TNF-alpha, His Tag (active trimer) (MALS verified) (Cat. No. TNA-H5228) with an affinity constant of 0.244 nM as determined in a SPR assay (Biacore T200) (Routinely tested).

Loaded Human IL-6 R alpha, Fc Tag (Cat. No. ILR-H5259) on Protein A Biosensor, can bind ActiveMax® Human IL-6, Tag Free(Cat. No. IL6-H4218) with an affinity constant of 35.9 nM as determined in BLI assay (ForteBio Octet Red96e) (Routinely tested).
参考文献:
[1] Lint S V , An M , Wilgenhof S , et al. Priming ofcytotoxic T lymphocyte responses by dendritic cells: induction of potentanti-tumor immune responses[M]. 2013.
[2] https://www.nature.com/articles/d43747-020-01096-y
[3] Yc A , Zy C , Xt A , et al. CAR-macrophage: A newimmunotherapy candidate against solid tumors - ScienceDirect[J]. Biomedicine& Pharmacotherapy, 139.
[4] Mangal JL, Handlos JL,Esrafili A, Inamdar S, McMillianS, Wankhede M, et al. Engineering Metabolismof Chimeric Antigen Receptor (CAR)Cells for Developing EfficientImmunotherapies. Cancers (Basel). 2021;13(5).






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining
















