2021年10月18日,信达生物宣布,达伯舒®(信迪利单抗注射液)联合达攸同®(贝伐珠单抗注射液)及化疗用于表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的EGFR突变非鳞状非小细胞肺癌的一项随机、双盲、多中心 III 期临床研究(研究代号:ORIENT-31)第一次期中分析达到主要研究终点。
这是全球首个证实PD-1抑制剂联合抗血管药物以及化疗在EGFR-TKI治疗进展的EGFR突变非鳞状NSCLC人群中显著提高PFS的前瞻性、双盲、多中心III期研究。
免疫疗法在诸如黑色素瘤、非小细胞肺癌等多种肿瘤中取得了优异的治疗效果,其中针对程序性死亡-1(PD-1)、程序性死亡配体1(PD-L1)的抗体被认为是癌症免疫治疗的最新突破。毫不夸张地说,PD-1/PD-L1抑制剂代表了新药史上迄今为止最成功的一类药物。早期的临床前证据表明,PD-1和PD-L1的激活抑制了肿瘤抗原特异性T细胞的激活和增殖,并促进了肿瘤发生,负向调节T细胞免疫功能。阻断这种相互作用会激活免疫系统来对抗癌症。
迄今为止,各个制药公司已经对不同类型的抗体进行了大约500项临床研究,涉及多达20种实体和血液系统恶性肿瘤。目前,FDA已经批准了多种用于PD-1信号阻断的抗体来治疗各类癌症。此外,还有其他用于阻断PD-1的抗体正在临床试验中。PD-1抑制剂是名副其实的药王。
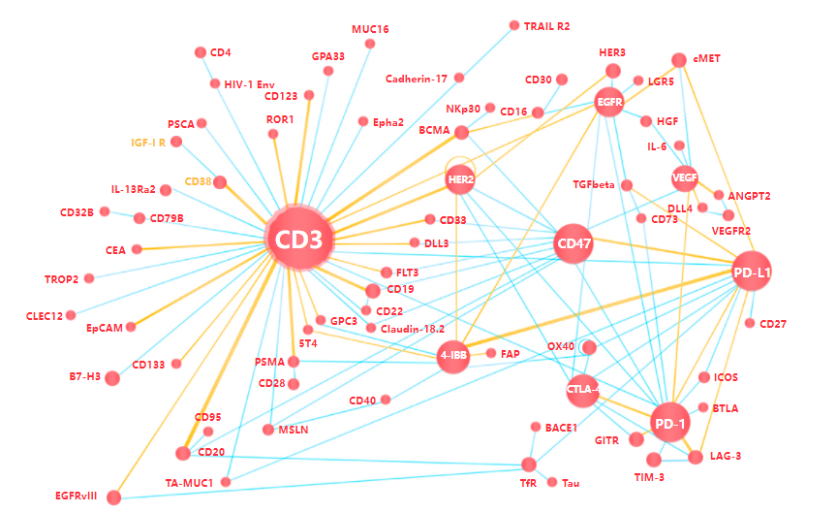
尽管PD-1抑制剂在同类药物中取得了无与伦比的成功,但是并不是所有的患者都对PD-1/PD-L1抑制剂治疗有反应,或者在治疗后发生了耐药的情况。鉴于抗PD-1/PD-L1单药治疗的临床局限性,越来越多的联合治疗出现,大多数联合疗法的指导原则是通过改善肿瘤抗原呈递或拯救功能失调的免疫效应细胞来提高PD-1阻断的功效。不同癌症疗法的组合使用可以提高反应率。但是联合治疗搭档的选择等,都会影响疗效和副作用,到底如何做才是真正最佳的拍档呢?让我们来看看PD-1抑制剂可以和哪些产生梦幻联动吧!
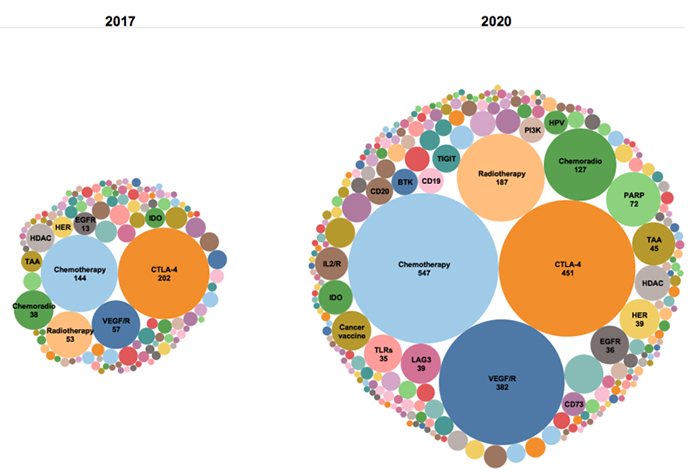
2020年和2017年与PD-1联合应用的靶点(来源:Nat Rev Drug Discov)
化疗通过在癌细胞死亡后促进肿瘤抗原呈递以及破坏免疫抑制因子来帮助启动肿瘤特异性T细胞,这有助于肿瘤退化过程。因此,化疗药物和PD-1抑制剂的适当组合可以增强PD-1抑制剂的功效,尤其是在免疫原性较低的化疗敏感性肿瘤中。免疫检查点抑制剂联合化疗已成功用于非小细胞肺癌(KEYNOTE-189,IMpower130)、小细胞肺癌(KEYNOTE-407,IMpower133)和三阴性乳腺癌(KEYNOTE-355,IMpassion13)。
放疗被认为可以改变T细胞的分化和功能,促进PD-L1的表达,这意味着增加放疗可以增强抗PD-L1治疗的效果。在临床试验和临床前模型中,放疗已显示出与各种免疫治疗的协同作用。据临床前研究报道,PD-1抑制剂和放疗联合可激活 CTL并减少髓源性抑制细胞。
由于无反应的肿瘤利用PD-1-PD-L1相互作用以外的免疫抑制途径。因此可以与其他免疫检查点抑制剂共同使用。比如经典的阻断PD-1+CTLA-4的联合疗法提高了疗效。CTLA-4(ipilimumab)和PD-1(nivolumab)抗体的组合可为黑色素瘤或肾细胞癌患者带来生存益处。但是不良反应的发生率高于单个疗法单独使用。PD-1抑制剂与抑制其他抑制性受体如 Lag-3和 Tim3联合治疗的临床试验正在进行中。
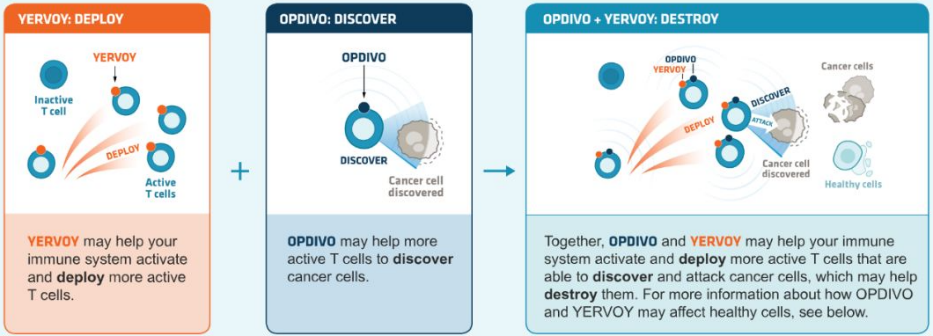
来源:BMS官网,中康产业资本研究中心
激动剂可以增强由PD-1阻断启用的抗肿瘤免疫反应。针对CD137(4-1BB)、CD134(OX40)、CD357 (糖皮质激素诱导的 TNFR;GITR) 和CD40等共刺激分子的激动性抗体在小鼠肿瘤模型的临床前研究和临床研究中都提供了持久的反应试验。部分研究结果表明,4-1BB激动剂和PD-1阻断剂的联合应用在临床前研究中产生了协同效应。联合抗GITR单克隆抗体GWN323和抗PD-1单克隆抗体 PDR001的I/Ib期临床试验正在进行中。OX40激动剂MEDI6469与抗PD-L1抗体MEDI4736联合的临床试验也在开发中。
免疫检查点封锁和嵌合抗原受体-T(CAR-T)细胞疗法分别是基于抗体的疗法和基于细胞的疗法,在对抗癌症中扮演重要角色。CAR-T细胞疗法与PD-1阻断剂的结合已被用于增强临床前模型和临床试验的治疗效果。例如在一项研究中,1例原发性纵隔大B细胞淋巴瘤患者在pembrolizumab治疗后对CD19 CAR-T细胞恢复反应。
T细胞招募双抗(TCB)占据了50%的双抗管线,但是如果T细胞本身是耗竭状态,则并无法起到杀伤肿瘤的活性,因而联合PD-1抗体,恢复T细胞活性,理论上可以增强抗肿瘤活性。而TCB则可以增加T细胞向肿瘤的重定向,克服冷肿瘤对PD-1抗体不敏感的问题。
其他与PD-1/PD-L1抑制剂联合的治疗包括、疫苗、细胞因子治疗和趋化因子抑制。
癌症疫苗将抗原呈递给免疫系统以产生抗肿瘤免疫反应。由于PD-1阻断剂的作用是启动自然免疫反应,将癌症疫苗与PD-1阻断剂联合使用可能是治疗免疫原性较低的肿瘤的合理方法。
与细胞因子的联用,目前研究较多的为PD-(L)1+VEGF(R)的组合。从机制上看,靶向VEGF的贝伐珠单抗本身具有抗血管生成作用,不仅对肿瘤血管生成和癌细胞的增殖有直接影响,还能增强肿瘤的免疫原性、T细胞的浸润等。贝伐珠单抗与抗PD-(L)1单抗联用,能够增强活化T细胞对肿瘤抗原的应答,进一步增强杀灭癌细胞的能力。
PD-1是肿瘤治疗百年难遇的黄金靶点,后PD-1时代,基于PD-1/PD-L1的联合治疗是药物开发及临床使用的重点。为了支持上述研究,ACROBiosystems依托自身技术平台,开发了包括PD-1、PD-L1在内的一系列高质量免疫检查点蛋白,可以广泛应用于免疫、抗体筛选、细胞功能验证等场景。产品具有以下特征:
此外,ACROBiosystems还可提供一系列CAR-T、双抗热门靶点蛋白。
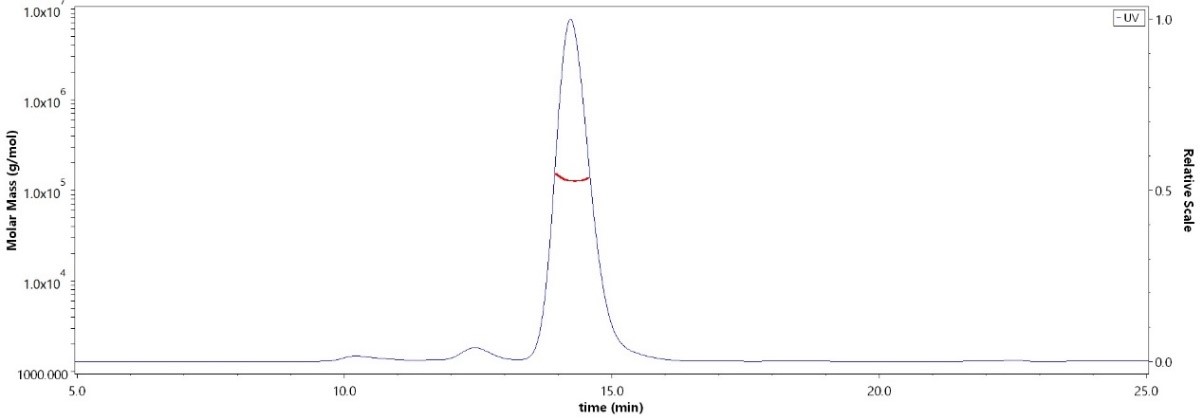
The purity of Human PD-1, Fc Tag, low endotoxin(Cat. No. PD1-H5257) was more than 90% and the molecular weight of this protein is around 105-145 kDa verified by SEC-MALS.

Immobilized Human PD-1, His Tag (Cat. No. PD1-H5221) at 2 μg/mL (100 μL/well) can bind.
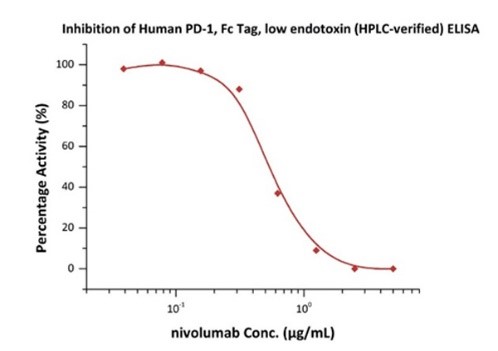
Nivolumab with a linear range of 0.1-3 ng/mL. Serial dilutions of nivolumab were added into Human PD-1, Fc Tag, low endotoxin (Cat. No. PD1-H5257): Biotinylated Human PD-L1, Fc, Avitag, His Tag (Cat. No. PD1-H82F3) binding reactions. The half maximal inhibitory concentration (IC50) is 0.5381 μg/mL (Routinely tested).
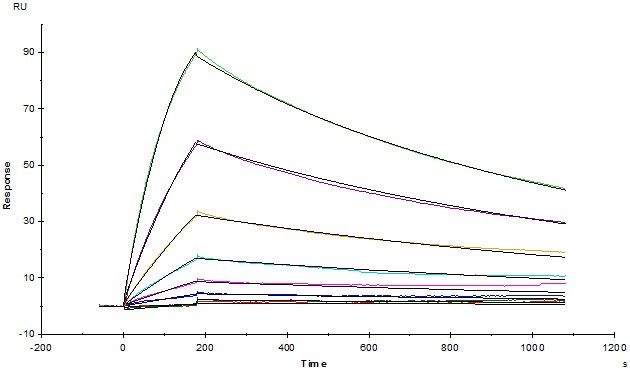
Opdivo (Nivolumab) captured on CM5 chip via anti-human IgG Fc antibodies surface, can bind Human PD-1, His Tag (Cat. No. PD1-H5221) with an affinity constant of 4.94 nM as determined in a SPR assay (Biacore T200) (Routinely tested).
参考文献:
[1] Chowdhury P S , Chamoto K, Honjo T . Combination therapy strategies for improving PD-1 blockadeefficacy: A new era in cancer immunotherapy[J]. Journal of Internal Medicine,2017.[2] Xu J , Wang Y , Shi J , et al. Combination therapy: A feasibility strategy for CAR-Tcell therapy in the treatment of solid tumors:[J]. Oncology Letters, 2018,16(2):2063-2070.




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
































 膜杰作
膜杰作 Star Staining
Star Staining