自2017年至今,以 Kymriah和Yescarta为代表的嵌合抗原受体T细胞(CAR-T)治疗相继被批准上市,细胞疗法在血液肿瘤治疗中取得突破性进展。然而,当研究进一步将注意力转向占据全部肿瘤90%比例的实体瘤时,该疗法并未得到令人满意的结果,实体瘤本身及其微环境的特殊性为细胞治疗带来了巨大挑战。一方面,实体瘤细胞抗原的异质性以及特异性肿瘤抗原的缺乏使CAR细胞难以对肿瘤细胞进行精准的靶向性识别和杀伤;另一方面,实体瘤特殊的肿瘤微环境,包括异常血管结构和基质成分组成的第一道物理屏障,以及TME 中多种免疫抑制细胞、抑制性免疫及代谢分子组成的二次屏障,使得细胞治疗药物难以浸润肿瘤组织。但随着对肿瘤生物学和免疫学的进一步研究,科学家开发了一些应对策略克服这些障碍,使得细胞疗法应用于实体瘤成为可能。
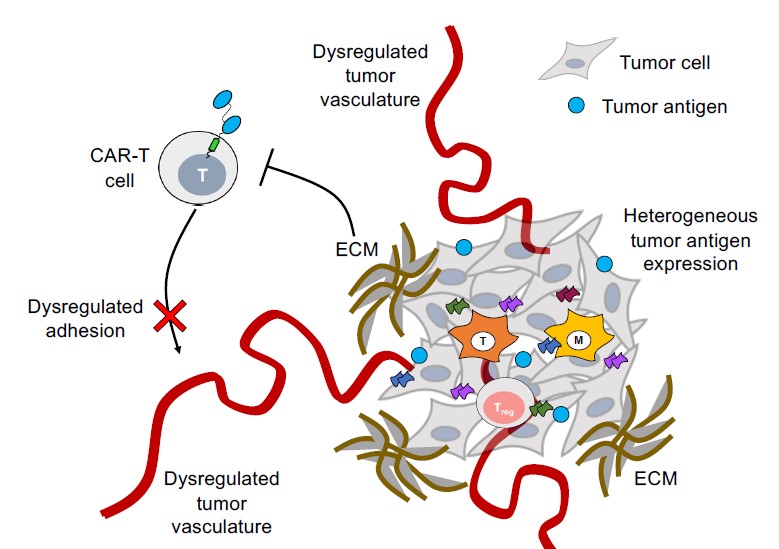
限制CAR-T发挥抗肿瘤作用的外部环境,Nature reviews. Drug discovery vol. 20,7 (2021): 531-550.
被修饰的T细胞缺乏浸润肿瘤实质的能力,导致其在体内效力有限,研究显示,整合素αvβ3在实体瘤的新生血管内皮细胞表面高度表达,靶向整合素可显著解决T细胞缺乏浸润能力的问题。另外,为了增强T细胞对肿瘤的归巢能力,一些趋化性手段给予T细胞强大的靶向实体瘤的能力,肿瘤细胞分泌的趋化因子与修饰T细胞上的趋化因子受体相结合可促进更多的T细胞到达实体瘤部位。
肿瘤微环境产生免疫抑制作用的主要原因是免疫抑制细胞的存在和免疫激活因子的缺乏。一些研究通过修饰CAR-T细胞,使其过度表达促进炎症的细胞因子(如IL-12、 IL-15和IL-18),这样的CAR-T细胞被称为“装甲”CAR-T细胞,可调节局部微环境。研究显示,在卵巢癌中,IL-12可以提高T细胞的增殖和存活能力,抵抗凋亡和PD-1诱导的功能抑制;此外,分泌IL-18的CAR-T细胞,可有效提高其增殖和浸润能力,并能募集内源性免疫细胞以调节TME。
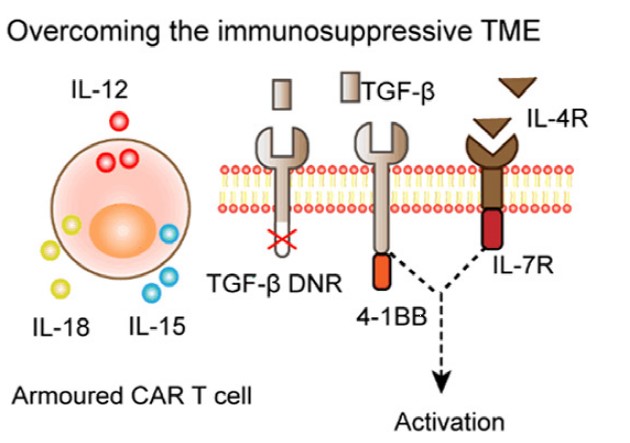
表达免疫激活因子降低TME中的免疫抑制,Am J Cancer Res. 2020;10(7):1979-1992
活化的T细胞上表达的免疫抑制性受体与表达在靶细胞上的配体具有高亲和力,明显抑制T细胞的效力,可采用基因编辑技术来破坏免疫检查点重新编程T细胞,研究显示,通过电转染编码sgRNA和Cas9敲除T细胞PD-1,细胞毒性显著增强,也有研究人员利用CRISPR/Cas9系统来敲除细胞毒性T细胞的CTLA-4,可抑制肿瘤生长并促进肿瘤根除。因此,阻断检查点的方法有助于提高T细胞的功效。
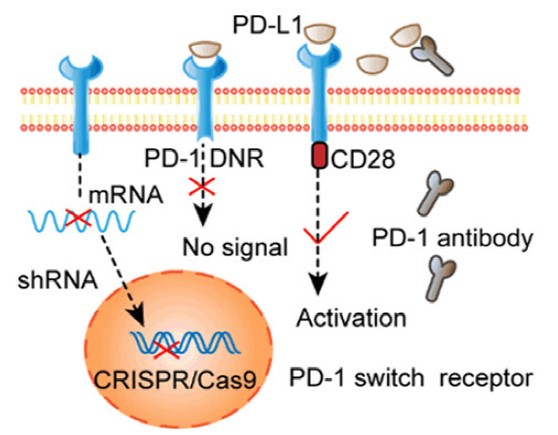
解除内源性T细胞抑制信号,Am J Cancer Res. 2020;10(7):1979-1992
CAR结构的抗原特异性直接决定了修饰T细胞的精确活性和安全性。然而对于实体瘤,肿瘤抗原的异质性导致无效的免疫监视,从而导致难治性和复发性肿瘤,目前,如MSLN、GPC3及HER2等靶点在某些实体瘤中具有相对较高肿瘤组织特异性,将它们作为 CAR-T治疗靶点,取得了较好的临床效果。另外,有报道证明肿瘤相关成纤维细胞(CAFs)能够促进血管生成,在实体瘤的进展和转移中发挥重要作用,所以,CAFs是肿瘤治疗的重要目标,由于FAP在CAFs上大量表达,研究人员开发了靶向FAP的CAR-T细胞,在动物模型试验结果中显示,可有效减少肿瘤基质并抑制肿瘤生长。因此,理想的特异性靶点是增强CAR-T 抗原识别的关键因素。
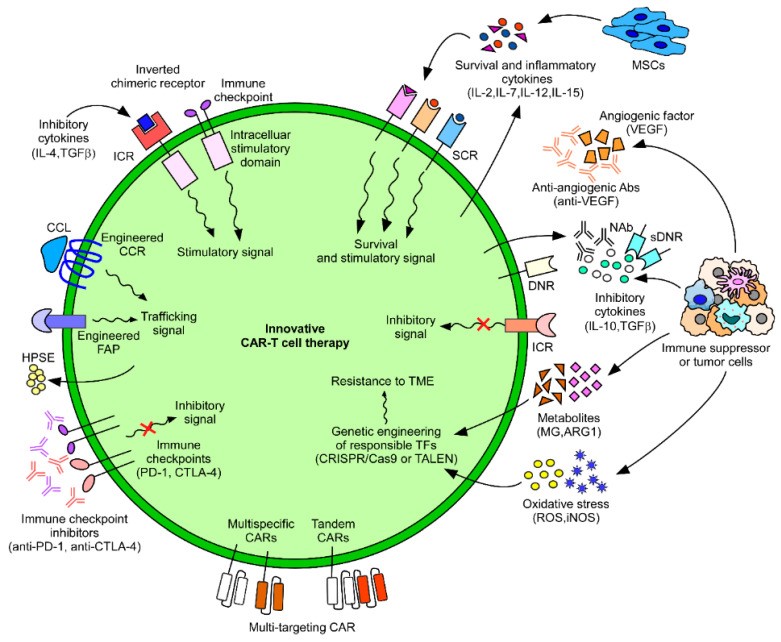
CAR细胞疗法应对实体瘤的策略 Cancers (Basel). 2020;12(8):2087.
CAR细胞疗法在实体瘤治疗中虽面临诸多困境,但随着对实体瘤及CAR细胞自身特征认识的不断加深,不断涌现的创新性解决策略为这一疗法带来了新的希望。无论是针对CAR细胞自身结构的优化改造,还是将该疗法与其他肿瘤治疗方法相结合,均呈现出良好的应用潜力,希望细胞治疗在实体瘤领域不断取得成效,最终使临床肿瘤患者获益最大化。
为全面支持细胞疗法在实体瘤的相关研究,ACROBiosystems百普赛斯专门开发了一系列包括MSLN、GPC3、FAP、HER2、EGFRvIII等在内的实体瘤相关靶点蛋白,覆盖不同种属和荧光标记类型,可用于免疫筛选、CAR表达质控及临床PK等研究,加速您细胞治疗药物研发进程。
点击查看更多热门实体瘤CAR靶点信息
✍ Human Her2蛋白(Cat. No. HE2-H5225),经ELISA验证,可与Trastuzumab高活性结合,可用于早期免疫、抗体筛选等研究。
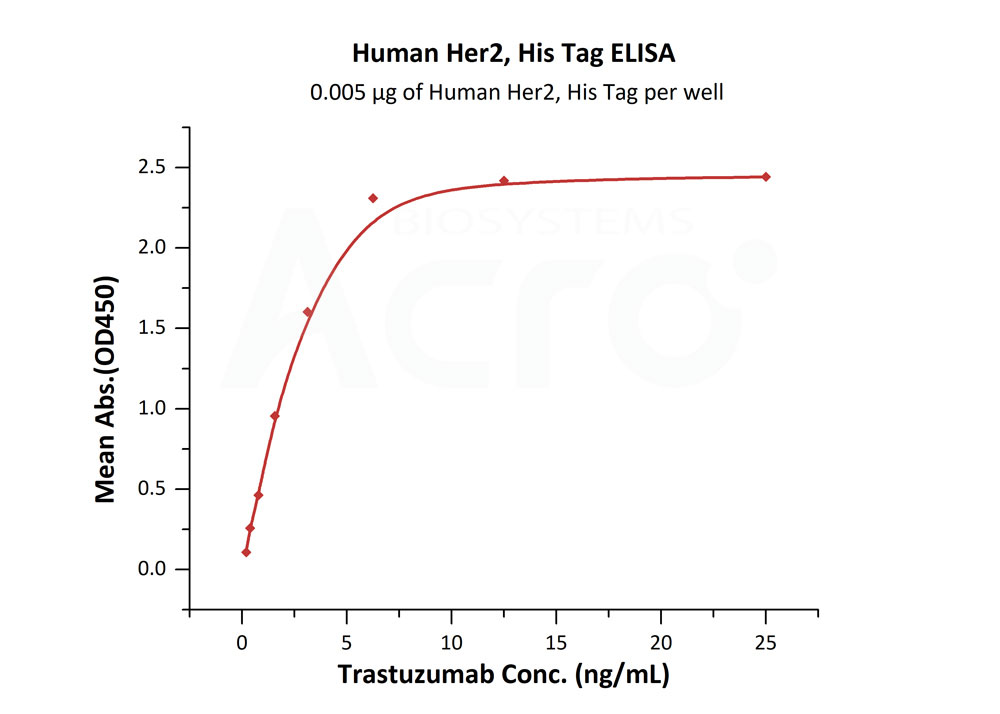
Immobilized Human Her2, His Tag (Cat. No. HE2-H5225) at 0.05 μg/mL (100 μL/well) can bind Trastuzumab with a linear range of 0.2-3 ng/mL (Routinely tested).
✍ PE-Labeled Human Glypican 3, His Tag (Cat. No. GP3-HP2E3),经FACS验证,可高特异检测GPC3 CAR表达。
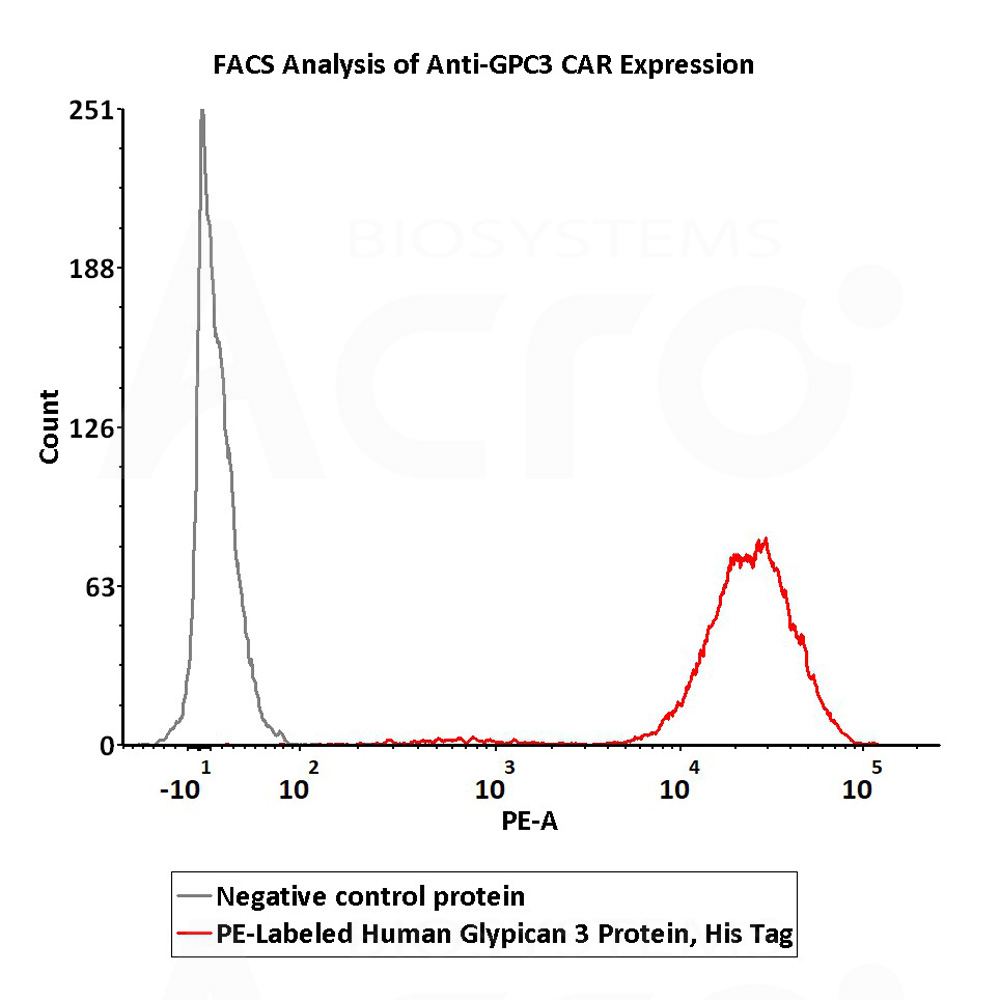
5e5 of anti-GPC3 CAR-293 cells were stained with 100 μL of 1:25 dilution (4 μL stock solution in 100 μL FACS buffer) of PE-Labeled Human Glypican 3, His Tag (Cat. No. GP3-HP2E3) and negative control protein respectively. PE signal was used to evaluate the binding activity (QC tested).
✍ Alexa Fluor 488-Labeled Human Mesothelin(Cat. No. MSN-HA2H9),可高特异检测MSLN CAR表达。
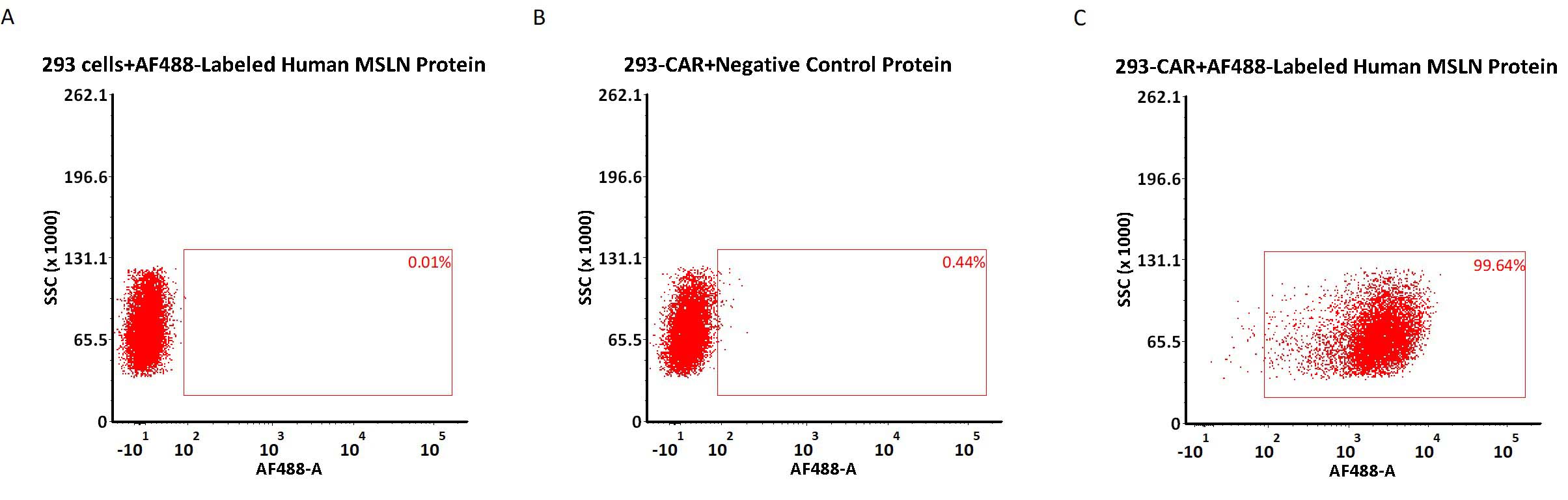
5e5 of anti-MSLN CAR-293 cells were stained with 100 μL of 3 μg/mL of AF488-Labeled Human Mesothelin (296-580), His Tag (Cat. No. MSN-HA2H9) and negative control protein respectively (Fig. C and B), and non-transfected 293 cells were used as a control (Fig. A). AF488 signal was used to evaluate the binding activity (QC tested).
ComboXTM,您身边的通用型研发工具
★★★★★ 新品推荐:链霉亲和素-HRP
参考文献
1. Safarzadeh Kozani, Pouya et al. “Recent Advances in Solid Tumor CAR-T Cell Therapy: Driving Tumor Cells From Hero to Zero?.” Frontiers in immunology vol. 13 795164. 11 May. 2022, doi:10.3389/fimmu.2022.795164
2. Hou, Andrew J et al. “Navigating CAR-T cells through the solid-tumour microenvironment.” Nature reviews. Drug discovery vol. 20,7 (2021): 531-550. doi:10.1038/s41573-021-00189-2
3. Jo, Yuna et al. “Innovative CAR-T Cell Therapy for Solid Tumor; Current Duel between CAR-T Spear and Tumor Shield.” Cancers vol. 12,8 2087. 28 Jul. 2020, doi:10.3390/cancers12082087
4. 姚铮, 李子涵, 高利明,等. CAR-T细胞免疫治疗实体瘤的研究进展[J]. 中国药科大学学报, 2021(004):052.
5. 郭菲菲. CAR-T 细胞治疗实体瘤的现存挑战及优化策略[J]. 中国肿瘤临床, 2022.




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
































 膜杰作
膜杰作 Star Staining
Star Staining






















