近年,干细胞疗法市场发展迅速,已经成为发展速度最快的药物市场之一。目前,全球约有1000+个在研干细胞疗法管线,占据主要比例的为间充质干细胞(Mesenchymal Stem Cell, MSC), 诱导多功能干细胞(induced Pluripotent Stem Cell, iPSC), 造血干细胞(Hematopoietic Stem Cell, HSC)等疗法。其中,MSC疗法因其多向分化、旁分泌协调、良好的免疫耐受性和可塑性的机制优势,已成为应用最广,在研管线数量最多的干细胞疗法,其在研疗法及药物管线约为500个。最近阶段有所突破的管线为在2024年10月26日经美国FDA批准进入临床实验的异体脂肪MSC(AD-MSC)药物NR-20201,其针对适应症为急性缺血性脑卒中。
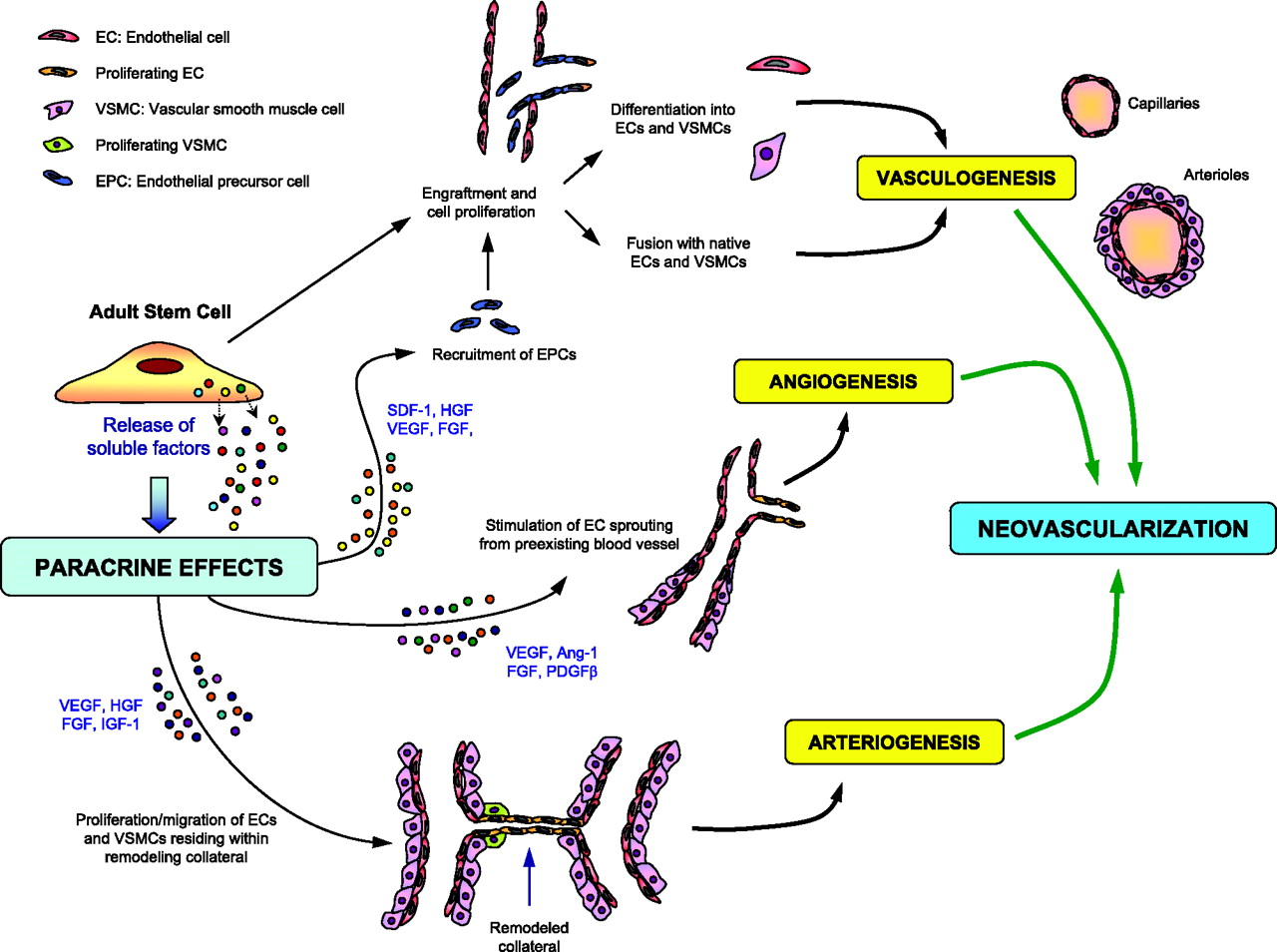
MSC具备自我更新及体内微环境诱导的定向多向分化特性,这使其在进行归巢现象后具备直接参与组织修复的能力。此外MSC自身的旁分泌作用使其合成分泌各类生长因子、细胞因子、趋化因子及其他调节信号,提供微环境稳态调控和细胞分化支持。常见的旁分泌因子主要包括:生长因子(VEGF、HGF、FGF-2、IGF-1)、细胞因子(IL-6、IL-10、TGF-β)、趋化因子(MCP-1、SDF-1)、调节因子(PGE2、SOD)等。
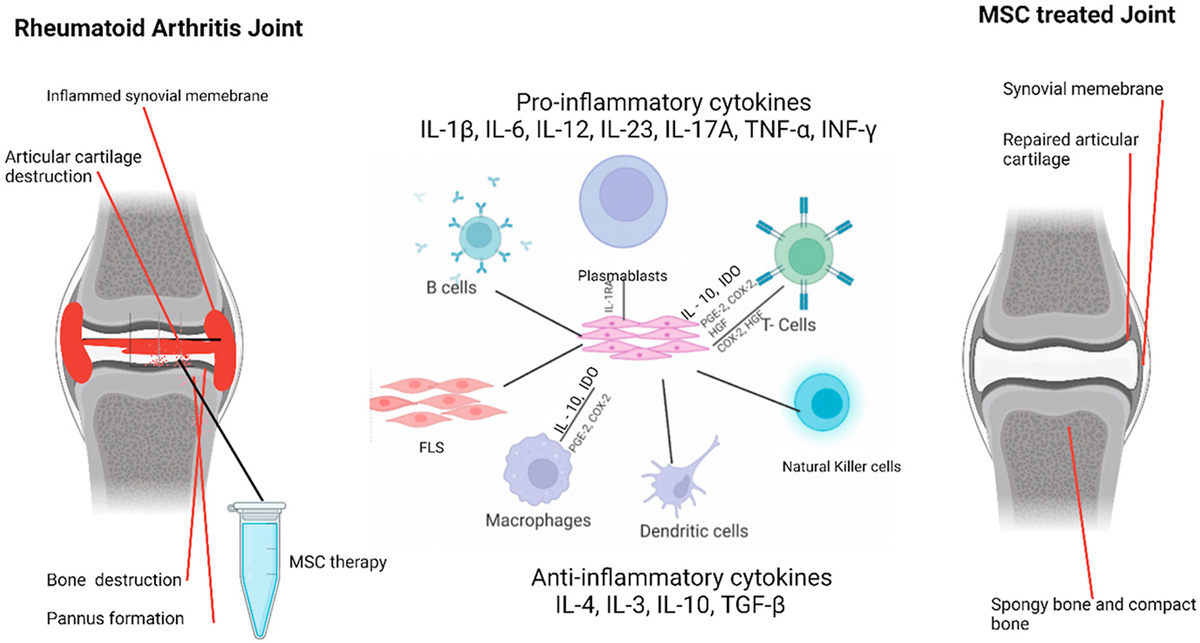
目前MSC疗法主要围绕组织修复和免疫调节作用,典型适应症包括心血管类疾病、组织损伤、膝骨类关节炎以及免疫疾病(如类风湿关节炎、炎症性肠炎、克罗恩病等)。其中旁分泌机制中产生的生长因子(如VEGF、HGF等)是血管形成的特异性标志物。而细胞因子(如IL-10、TGF-β等)则为调节抑制炎症的标志物。
图1. 旁分泌 – 生长因子旁分泌及血管成形术示意图
图2. 旁分泌 – 炎症因子旁分泌示意图
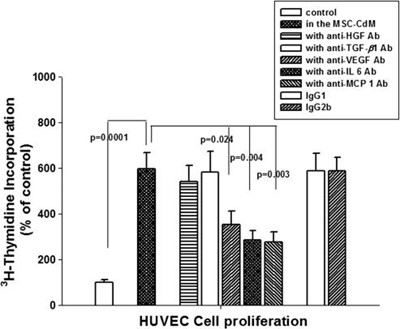
在2011年批准上市的Cellgram®-AMI,是全球首个治疗急性心肌梗死的上市MSC干细胞药物。利用自体骨髓MSC的定向分化及旁分泌机制,实现冠状动脉成形术。在已发表在NIH文献中数据表明,Cellgram®-AMI研发基于GMP标准,在药物开发阶段的MOA建立中检测一系列分泌因子来确定可影响心肌及血管生成的MSC旁分泌蛋白,包括VEGF、HGF、IL-6、TGF-β、MCP-1等(图3)。在临床前实验中,研究人员通过对细胞上清中的VEGF、IL-6、MCP-1表达水平进行监控从而来评估其药理药效。
图3. Cellgram®-AMI旁分泌生长因子及细胞因子检测数据
此外,在自免炎症疾病领域,考虑到传统自免药物治标不治本的局限性,MSC疗法因其特性成为自免类疾病(如类风湿关节炎(RA)、炎症性肠炎(IBD)、克罗恩病(CD)等)药物治疗的新方向。目前已有针对RA的MSC干细胞疗法进入临床I/II期,在其药物作用机制(Mechanism of action)研究中通过检测血液样本中IL-10,HGF、TGF-β等生长及抗炎细胞因子来评估其药效。
图4. 针对RA的MSC临床前MOA验证检测标志物 – IL-10, TGF-β
图5. 针对RA的MSC临床前实验检测标志物 – HGF, VEGF, SDF-1, KGF, FGF, IGF-1等
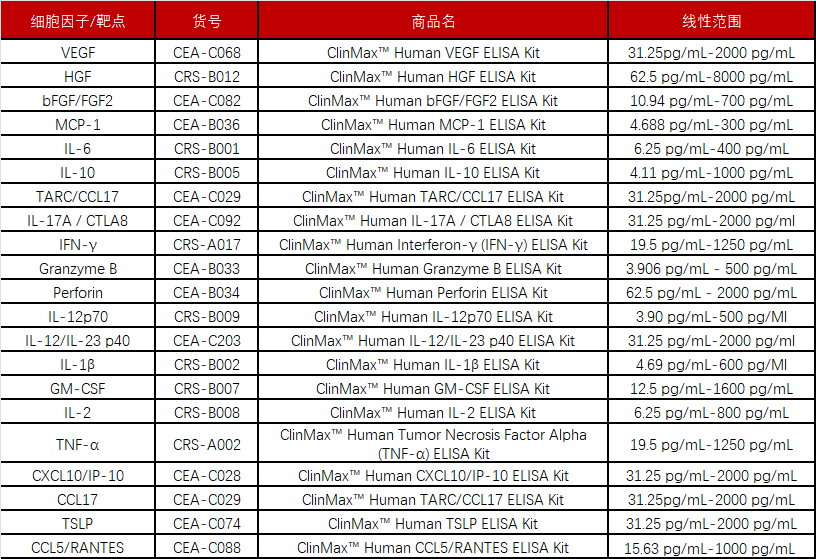
针对不同适应症的MSC药物开发过程中,检测其旁分泌相关因子的含量是早期药理药效研究、临床前及临床实验中重要的生物标志物。针对心血管及组织损伤类疾病,VEGF、HGF、MCP-1等生长因子的分泌含量是重要的检测标准。针对自免炎症类疾病,抗炎促炎细胞因子(如IL-10、IL-6、TGF-β、MCP-1)的分泌量则成为免疫调控反馈的重要参照。目前,干细胞疗法的管线数量逐年上升,竞争压力增加。为了加速药物研发,我们提供多种分析生物标志物(biomarker、cytokine)的定量分析ELISA试剂盒 。试剂盒性能经过真实样本充分验证,保证分析结果的精确性、特异性、准确度、灵敏度和一致性。Human VEGF ELISA Kit (Cat. No. CEA-C068)
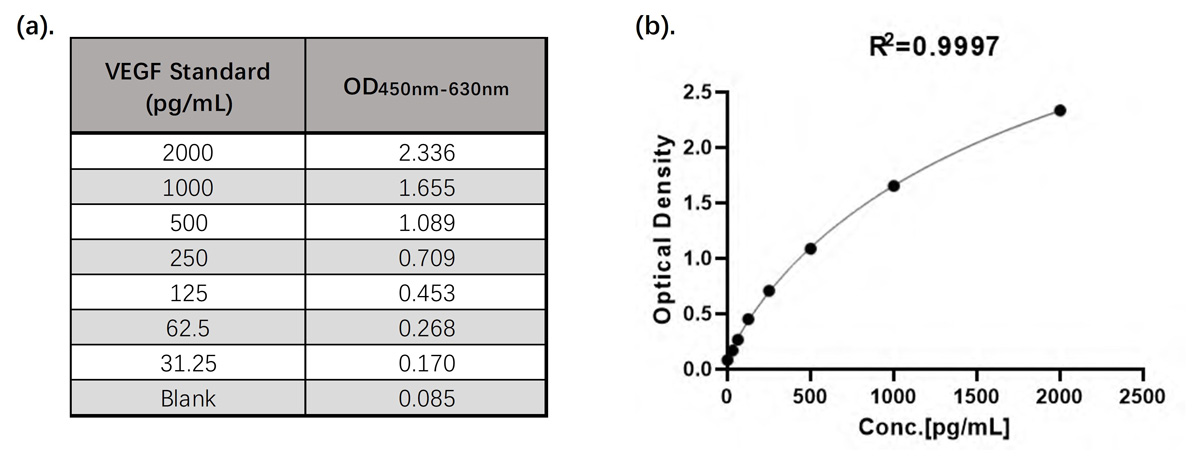
线性范围
ClinMax™人VEGF ELISA检测试剂盒的线性检测范围为31.25 pg/mL – 2000 pg/mL。具体数据见图6.
图6. (a). CEA-C068试剂盒标准品线性检测数据(OD450nm-630nm); (b). CEA-C068试剂盒标准品四参数方程拟合线性图
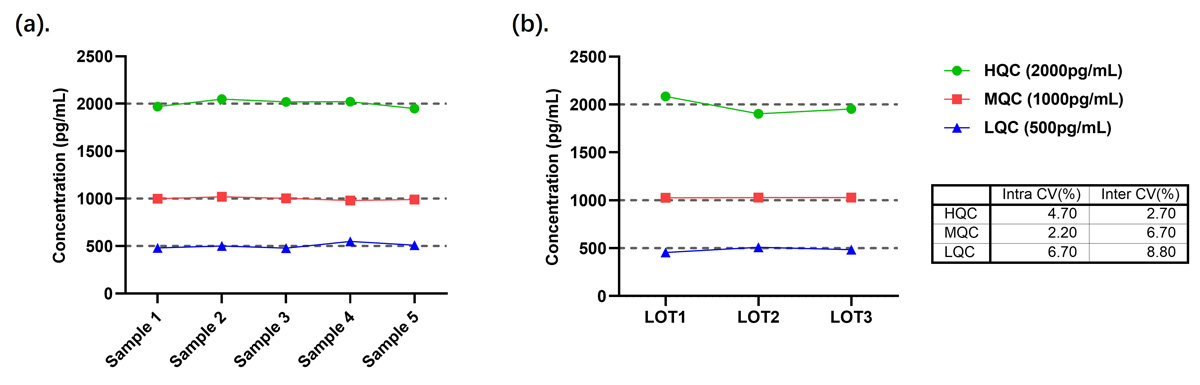
按本产品(CEA-C068)操作说明,测定3个浓度的质控品,每个质控品重复检测10次,计算10次测量结果的平均值(M)、标准差(SD)和变异系数(CV)。结果显示,测定质控品的CV都低于10%,具体结果见图7。
按本产品(CEA-C068)操作说明,测定3个批次3个浓度的QC(pg/mL),每个质控品重复检测3次,计算9次测量结果的平均值(M)、标准差(SD)和变异系数(CV)。结果显示,测定质控品的CV都低于15%,具体结果见图7。
图7. (a). CEA-C068批内精密度数据图;(b). CEA-C068批间精密度数据图及CV值
回收率
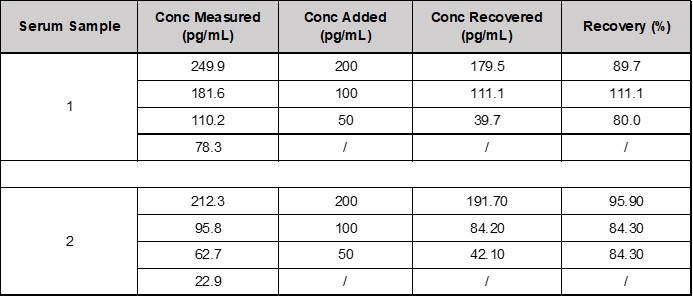
将本产品(CEA-C068)中的参考品,用样本稀释液分别配置成高值血清样本,按照1:19的体积比例加标到血清样本中。按照试剂盒说明书,每个样本均检测2次,求出检测结果的浓度值的平均值。回收率的计算公式=(加标样本值-Blank样本值*0.9)/理论值×100%。本产品回收率都在85.87%的范围内(见下表1)。
表1. CEA-C068回收率数据
稀释线性
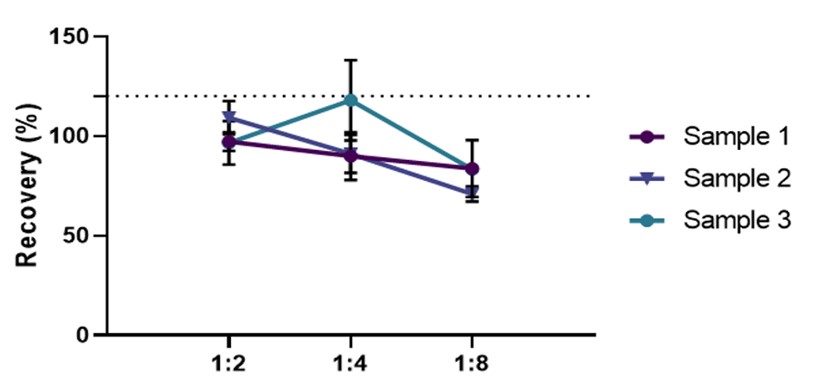
将本产品(CEA-C068)中VEGF参考品,用血清样本配置成为高值血清/血浆/细胞上清样本,用样本稀释液依次按1:1进行稀释,每个稀释浓度均检测2次,求检测结果的浓度值的平均值,结果显示,血清/血浆/细胞上清样本各稀释点的检测浓度应都在该待测物浓度标示值的±20%范围内,线性相关系数R²应大于0.95 (见图8)。
图8. CEA-C068稀释线性曲线图
Human MCP-1 ELISA Kit (Cat. No. CEA-B036)
线性范围
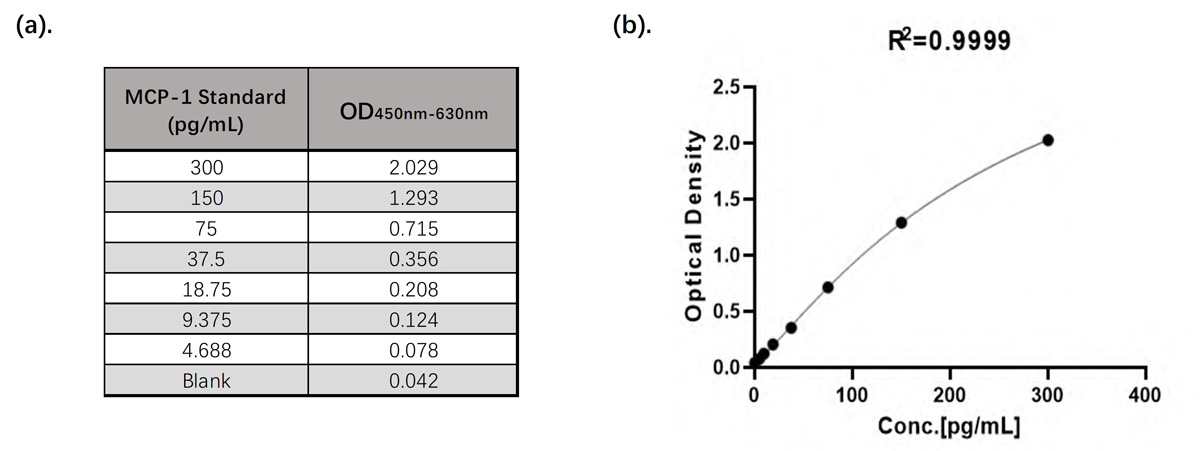
ClinMax™人MCP-1 ELISA检测试剂盒的线性检测范围为4.688 pg/mL – 300 pg/mL。具体数据见图9.
图9. (a). CEA-B036试剂盒标准品线性检测数据(OD450nm-630nm); (b). CEA-B036试剂盒标准品四参数方程拟合线性图
批内、批间精密度
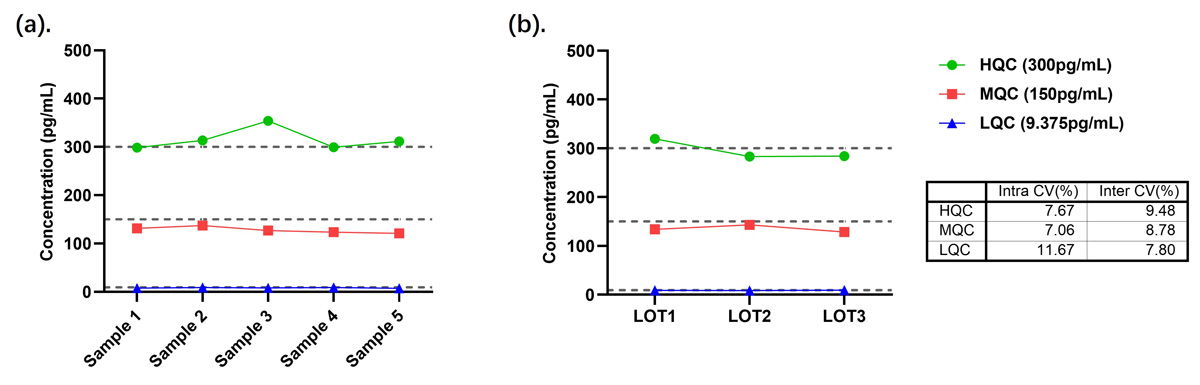
按本产品(CEA-B036)操作说明,测定3个浓度的质控品,每个质控品重复检测10次,计算10次测量结果的平均值(M)、标准差(SD)和变异系数(CV)。结果显示,测定质控品的CV都低于10%,具体结果见图10。
按本产品(CEA-B036)操作说明,测定3个批次3个浓度的QC(pg/mL),每个质控品重复检测3次,计算9次测量结果的平均值(M)、标准差(SD)和变异系数(CV)。结果显示,测定质控品的CV都低于15%,具体结果见图10。
图10. (a). CEA-B036批内精密度数据图;(b). CEA-B036批间精密度数据图及CV值
回收率
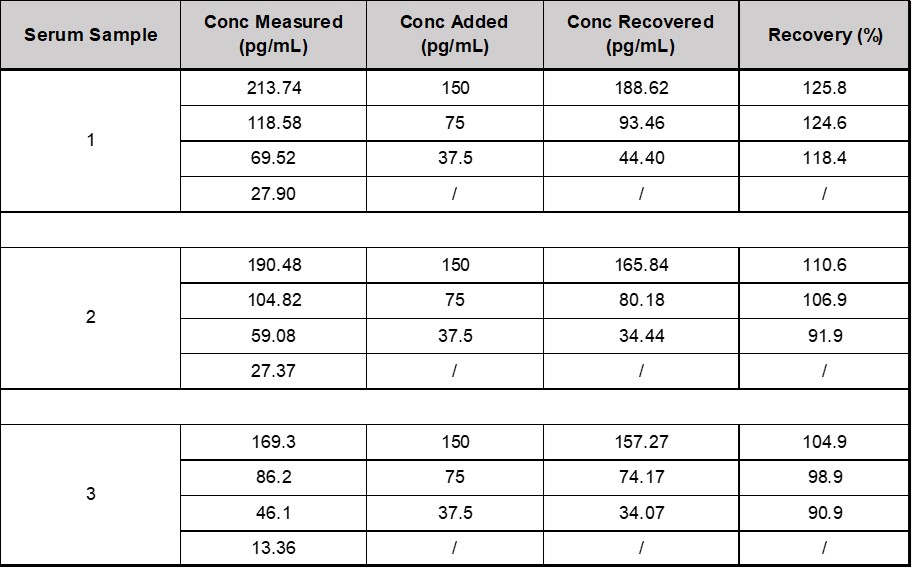
将本产品(CEA-B036)中的参考品,用样本稀释液分别配置成高值血清样本,按照1:19的体积比例加标到血清样本中。按照试剂盒说明书,每个样本均检测2次,求出检测结果的浓度值的平均值。回收率的计算公式=(加标样本值-Blank样本值*0.9)/理论值×100%, 本产品回收率都在的范围内80% - 130%(见下表2)。
表2. CEA-B036回收率数据
稀释线性
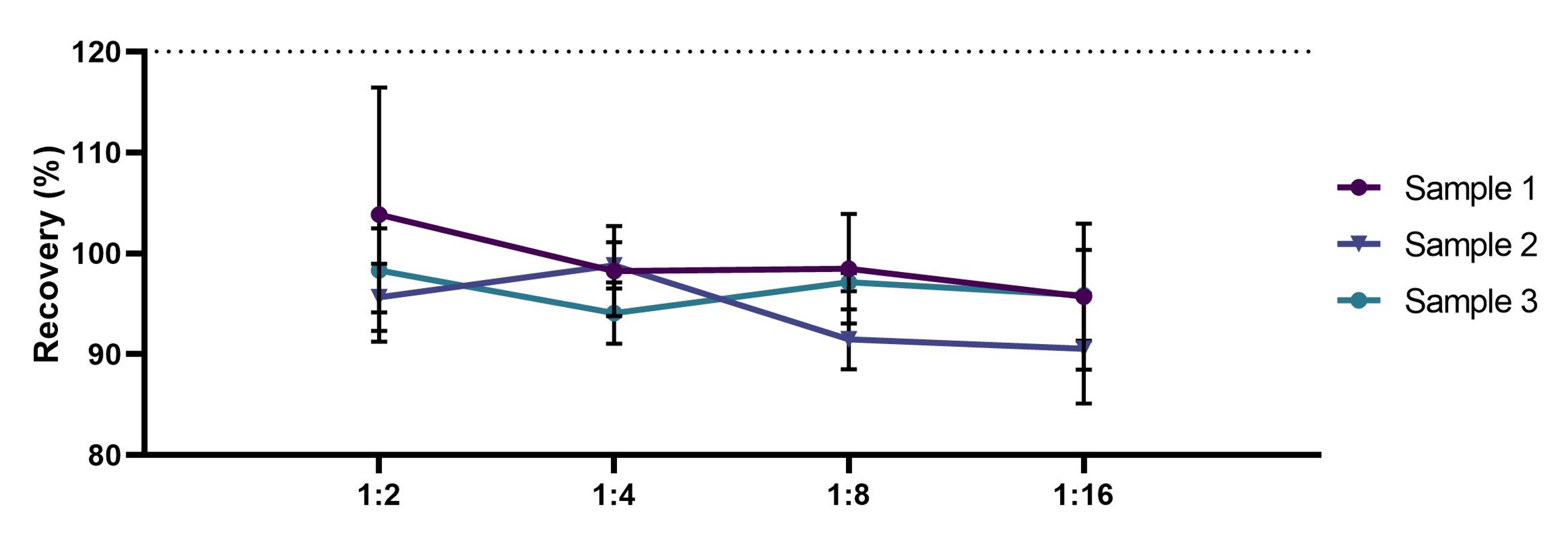
将本产品(CEA-B036)中MCP-1参考品,用血清样本配置成为高值血清/血浆/细胞上清样本,用样本稀释液依次按1:1进行稀释,每个稀释浓度均检测2次,求检测结果的浓度值的平均值,结果显示,血清/血浆/细胞上清样本各稀释点的检测浓度应都在该待测物浓度标示值的±20%范围内,线性相关系数R²应大于0.95 (见图11)。
图11. CEA-B036稀释线性曲线图
>>>点击图片了解resDetectTM残留检测解决方案






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining