为了助力相关研究,ACROBiosystems百普赛斯开发了500+免疫检查点蛋白产品、过表达/报告基因细胞系、抑制剂筛选试剂盒和PK血药浓度检测试剂盒,这一系列产品可满足从免疫、抗体筛选和表征、稳定性测定到后期的生产质控全流程,协助加速免疫疗法研发。
免疫检查点抑制剂的开发彻底改变了癌症患者的治疗标准,特别是阻断PD-1/PD-L1信号是目前最成功的免疫治疗策略之一。然而,ICIs的临床应用仍面临许多挑战,包括只有少数接受ICIs治疗的患者能够获得持久的反应,以及正常组织中抑制性和共刺激性信号失衡导致的较高irAE发生率和耐药性问题。
数据表明,开发新型靶向免疫检查点的双特异性抗体(bsAbs)是一种有前景的方法来克服上述挑战,双抗可以同时结合两个不同的表位,通过同时阻断不同免疫检查点,解决了不同免疫检查点间存在的补偿机制,能更好的发挥治疗效果。并且相比于单抗及联合用药治疗,双抗还能更精确的桥连免疫细胞和肿瘤细胞,避免了机体
T 细胞的广泛激活,降低药物脱靶效应,减少副反应发生率,也减少了药物使用剂量。
本文介绍了新兴的免疫检查点靶向双特异性抗体。(产品推荐:双抗热门靶点及服务)
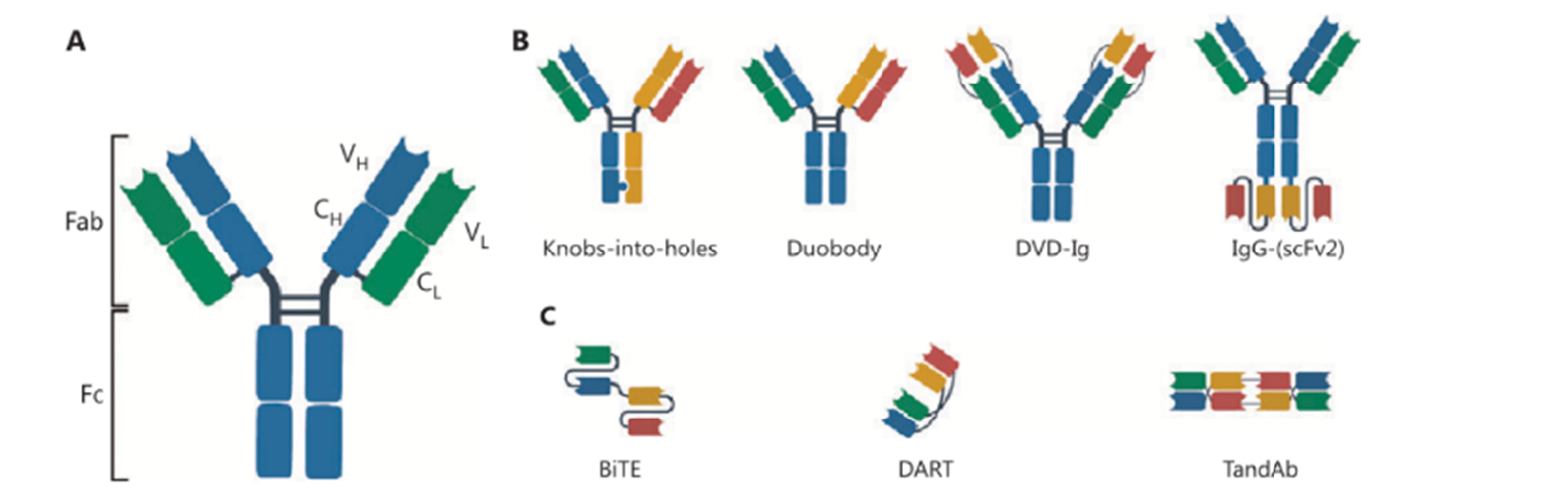
图1:双抗的分类
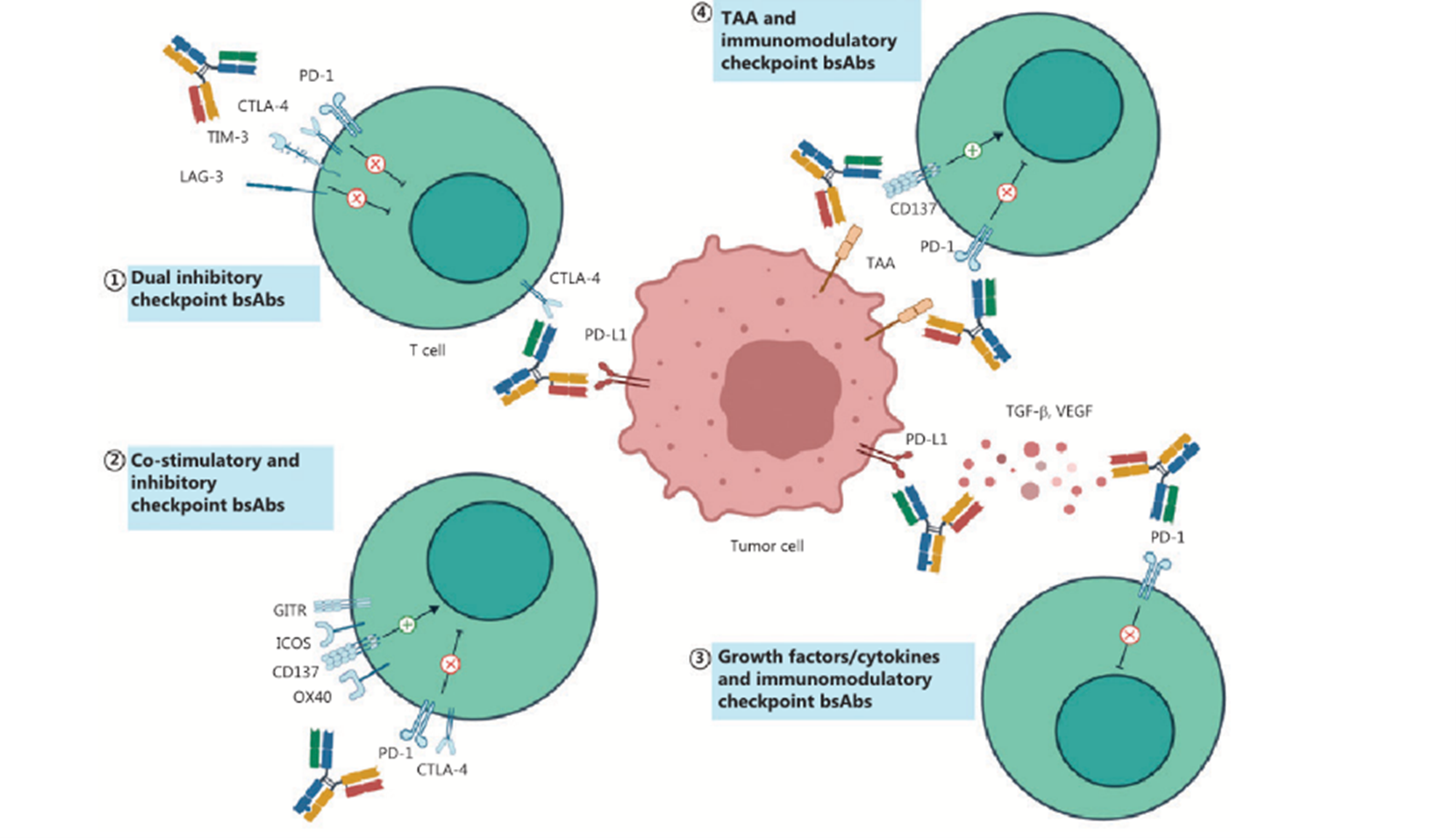
免疫检查点可分为共刺激和共抑制两类。癌细胞异常表达的抑制性检查点是免疫逃逸和药物耐药的基础。靶向免疫检查点的双抗主要可分为靶向双抑制性免疫检查点、靶向共刺激和抑制性检查点及靶向免疫调节检查点和非检查点三类。
图2:靶向免疫调节检查点的双抗分类:靶向双重抑制性检查点(①);靶向共刺激和抑制性检查点(②);以及靶向免疫调节检查点和非检查点靶标(③④)。
PD-1 x CTLA-4
PD-1和CTLA-4抑制剂的联合治疗尽管提高了疗效,但显著增加了irAEs的发生率。有研究表明,PD-1×CTLA-4双抗比联合疗法具有更强的抗肿瘤活性且irAEs可控。
-
领跑者- Cadonilimab
针对双抑制性检查点的双抗中,康方生物开发的卡多尼利单抗(Cadonilimab)是首个获批上市并用于治疗复发性或转移性宫颈癌的双抗。临床数据表明,Cadonilimab与化疗药物联合使用在晚期胃癌或食管腺癌患者中表现出良好的耐受性和较高的客观缓解率(ORR
=
66.7%)。另一项临床试验评估了Cadonilimab与仑伐替尼联合治疗肝细胞癌患者的疗效,结果显示ORR为44.4%,且安全性可控。Cadonilimab获批后,多项相关临床研究正在推进中。4月24日,Cadonilimab注射液的一项新适应症上市申请获得CDE受理,拟加含铂化疗联合/不联合贝伐珠单抗对比安慰剂加含铂化疗联合/不联合贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌。
-
Vudalimab
另一种PD-1×CTLA-4双抗Vudalimab(XmAb20717)的一期临床试验表明,Vudalimab
在接受过免疫检查点抑制剂预处理的晚期癌症患者中具有良好耐受性。此外,Vudalimab单药或联合化疗或靶向药物治疗转移性去势抵抗性前列腺癌患者的二期临床试验已启动。
-
纳米抗体新进展
近期,上海细胞治疗集团的研究人员在Nature子刊Oncogen上发表了研究论文,研究开发一种双特异性纳米体Z15-0,精确靶向PD-1和CTLA-4。体外显示具有生物活性和功能。进一步过优化编码Z15-0的mRNA序列获得Z15-0-2,并采用LNP递送系统(LNP
mRNA),实现体内外纳米体的增强表达,纳米抗体优势在于组织穿透性好,同时显示出改善的抗肿瘤活性,为癌症治疗提供新方法。

此外,靶向PD-L1 x CTLA-4的双抗研究也在进行中。康宁杰瑞开发的KN046(PD-L1 x CTLA-4)已在中国、美国及澳大利亚开展包括非小细胞肺癌在内的多项处于不同阶段的临床研究。
针对其他抑制性检查点分子(如LAG-3、TIGIT)的双抗也正在积极开发中。
LAG-3 × PD-1
LAG-3靶点是继CTLA-4、PD-1/L1之后第三个应用于临床的免疫检查点抑制剂。由于LAG-3
表达与PD-1表达密切相关,同时靶向LAG-3和PD-1是一种有前景的治疗策略。靶向LAG-3的双抗进展较快的有Tebotelimab(MGD013)、FS118
以及CB213 等,其中Tebotelimab已进入Ⅲ期临床试验。
-
Tebotelimab
Tebotelimab(MGD013)是一种双特异性四价DART分子,可同时阻断PD-1和LAG-3,从而恢复衰竭型T细胞的功能。与单独阻断PD-1或LAG-3信号相比,Tebotelimab显示出更强的T细胞激活能力和细胞因子分泌能力。
近日,Nature Medicine上发表的一期临床研究结果的论文初步验证了Tebotelimab单药或联用Margetuximab(HER2单抗)在HER2+复发性/难治性晚期实体瘤患者中的安全性与有效性。
此外,靶向LAG-3×CTLA-4的双抗(比如XmAb22841)也在研究中。
TIM-3 × PD-1
TIM-3调节肿瘤的免疫反应并导致效应性T细胞功能障碍。TIM-3表达上调可能介导抗PD-1治疗耐药,通过TIM-3抗体可逆转这种耐药。
RG7769(TIM-3
×
PD-1)是一种由罗氏开发的异二聚体TIM-3×PD-1双抗,可高亲和力结合PD-1、低亲和力结合TIM-3。临床前研究显示,RG7769促进肿瘤特异性T细胞分泌IFN-γ,并增强肿瘤浸润性T细胞的抗肿瘤活性。最近启动的II期研究旨在评估RG7769与纳武单抗在晚期或转移性食管鳞状细胞癌中的疗效。
TIGIT× PD-L1
TIGIT能够通过与PVR和PVRL2作用抑制免疫细胞的细胞毒作用,近期报道的一种TIGIT × PD-L1双抗能够促进T细胞分泌IL-2,并在小鼠模型中证实能够提高生存率。HLX301和PM1022均为靶向TIGIT和PD-L1的双抗,目前均处于I期临床试验阶段。
共刺激信号通路对T细胞的激活、增殖、分化及效应功能至关重要。研究表明,靶向共刺激分子的双抗具有强大的抗肿瘤活性和低脱靶毒性,同时降低了使用共刺激检查点激动剂时的安全性问题。目前针对GITR、OX40、4-1BB和ICOS等共刺激靶点的双抗研究较多。
GITR× PD-1或GITR×CTLA-4
GITR介导T细胞激活并破坏调节性T细胞的免疫抑制作用。研究表明,抗GITR抗体可调节肿瘤浸润T细胞,并与抗PD-1
mAb结合降低TIGIT表达。这为探索靶向GITR和其他免疫检查点的双抗提供了基础。将多聚化GITR与抗PD-1
mAb融合形成双抗,从而触发T细胞的浸润,减少Treg和耗竭T细胞。
此外,GITR×CTLA-4 双抗也具有临床应用潜力。ATOR1144(GITR×CTLA-4)已被证明可以增加Treg耗竭并激活肿瘤反应,但其临床效果仍有待验证。
4-1BB × PD-L1
4-1BB在T细胞增殖和效应功能中起关键作用。但有限的有效性及严重的肝毒性限制了4-1BB激动剂的应用。靶向4-1BB的双抗通过限制其在特定免疫细胞中的刺激能力来减少4-1BB激动剂的毒副作用。
-
ABL503
天境生物与ABL Bio合作开发的差异化PD-L1 x 4-1BB双抗ABL503,通过阻断PD-L1信号并刺激4-1BB信号,激活T细胞产生抗肿瘤协同作用,其具有良好的耐受性。
-
GEN1046
另一靶向4-1BB×PD-L1的双抗GEN1046,结合了Genmab的DuoBody®技术平台和BioNTech的免疫调节抗体,通过条件激活T细胞和NK细胞上的4-1BB来引发抗肿瘤反应,可通过增加T细胞增殖和分泌IFN-γ、IL-10和CXCL10等细胞因子而抑制肿瘤生长。今年ASCO大会上,GEN1046在免疫检查点抑制剂进行标准治疗失败的非小细胞肺癌
(NSCLC) 患者上展现出鼓舞人心的数据。
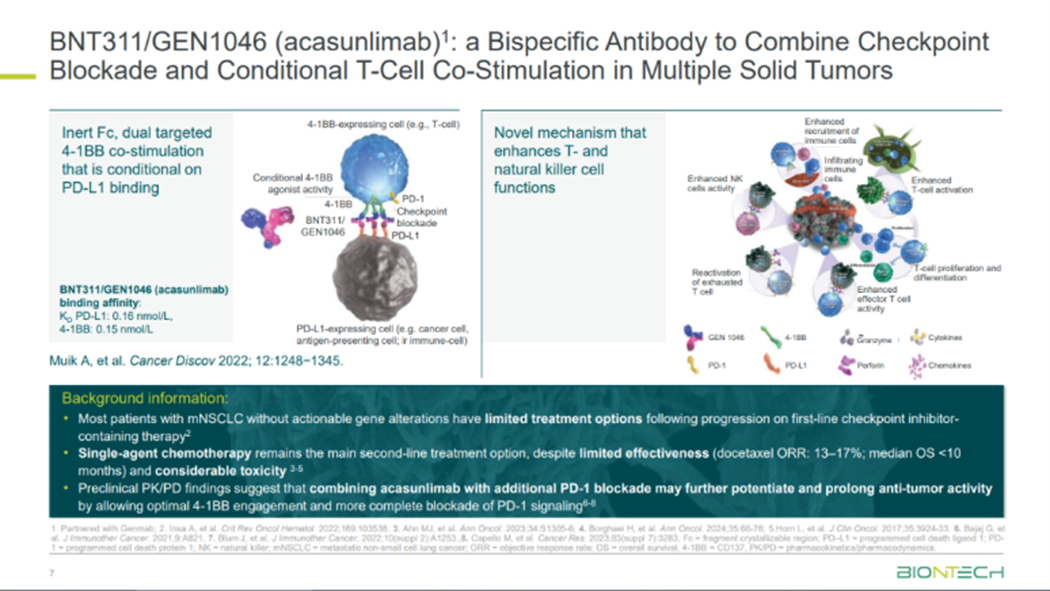
此外,包括ATG-101、INBRX-105和QLF31907在内的多种4-1BB×PD-L1双抗目前正在进行一期临床试验,以评估对晚期实体瘤患者的疗效。
OX40 × PD-L1/CTLA-4
OX40在T细胞分化、活化和记忆T细胞维持方面起着重要作用,在T细胞受体激活后短暂表达于CD4 +和CD8 + T细胞上,在肿瘤内Treg细胞中持续表达。
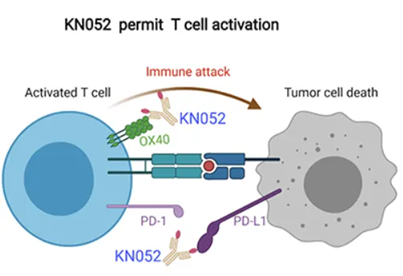
康宁杰瑞自主研发的PD-L1/OX40双抗KN052,可有效阻断PD-L1与PD-1的相互作用,并激活OX40信号通路。增强T细胞的活化的同时并减少Treg介导的免疫抑制,协同增强抗肿瘤活性。目前针对实体体瘤患者的I期研究目前正在进行中。
此外,有研究证实,靶向OX40和CTLA-4的双抗降低了TME中Treg细胞浓度,并激活了效应T细胞和记忆T细胞。一期临床试验报道了靶向CTLA-4 x OX40的双抗ATOR-1015在晚期实体瘤患者中具有适度的有效性和良好的安全性。
ICOS× PD-L1
ICOS的表达依赖于TCR激活,并且在Treg细胞中持续表达。ICOS激动剂抗体已在多项临床试验中进行评估。KY105是一种新型的ICOS×PD-L1双抗,以PD-L1依赖的方式激活ICOS。在结直肠癌小鼠模型中,KY105通过清除ICOS
+ Treg细胞并增加IFN-γ分泌发挥抗肿瘤疗效。
-
靶向免疫检查点和TAAs
ICI单药治疗缺乏肿瘤选择性,因此可能引起不可预测的irAEs。将TAAs与免疫调节检查点结合可解决这些问题。
EpCAM在许多正常上皮组织中表达,也被认为是癌细胞的标志物。设计了CD40×EpCAM双抗促进了肿瘤特异性T细胞的初始反应并延长了小鼠模型的整体生存期。此外,同时靶向酪氨酸受体激酶(EGFR、HER2、HER3和HER4)和免疫检查点的双抗正在研发中。
除了靶向肿瘤抗原和检查点的双抗外,靶向GF和细胞因子可能为癌症提供额外的免疫治疗策略疗法。
-
靶向免疫检查点和GFs/细胞因子
促肿瘤生长因子(GF)和细胞因子的特异性功能作为“增强剂”,改善肿瘤杀伤效果并减少耐药性。其单药或联合ICIs治疗药物已获批用于临床治疗。将生长因子或细胞因子融合到免疫检查点靶向双抗中不仅增强了免疫疗法的有效性,而且精确地引导生长因子/细胞因子治疗到达肿瘤区域。
AK112是一种针对VEGFxPD-1的双抗,一项一期临床试验评估了AK112在治疗实体瘤患者中的疗效。AK112在铂类难治性/耐药性上皮卵巢癌患者中ORR达23.5%且安全性良好。
此外,TGF-β与PD-1 / PD-L1的双抗也在研究中。YM101是一种靶向PD-L1xTGF-β的双抗,与单个抗TGF-β或抗PD-L1治疗相比,体外和体内实验均显示YM101具有更强的抗肿瘤活性。
产品推荐:更多细胞因子相关产品
讨论
对于与免疫调节检查点结合双抗,其优点包括阻断两种不同的抑制性信号、向特定免疫细胞输送激动型信号以在免疫抑制TME中激活免疫反应,并且在选定肿瘤组织中局部化刺激或抑制作用。随着对双抗机制研究的不断深入和双特异性分子构建的持续优化,靶向免疫检查点的双抗有望成为癌症治疗的新药。
为了助力相关研究,ACROBiosystems百普赛斯开发了500+免疫检查点蛋白产品、过表达/报告基因细胞系、抑制剂筛选试剂盒和PK血药浓度检测试剂盒,这一系列产品可满足从免疫、抗体筛选和表征、稳定性测定到后期的生产质控全流程,协助加速免疫疗法研发。
经 SEC-MALS 验证,人源CTLA-4, His Tag (Cat. No. CT4-H52H9) 的纯度超过90%,且该蛋白的分子量约为 45-60 kDa。
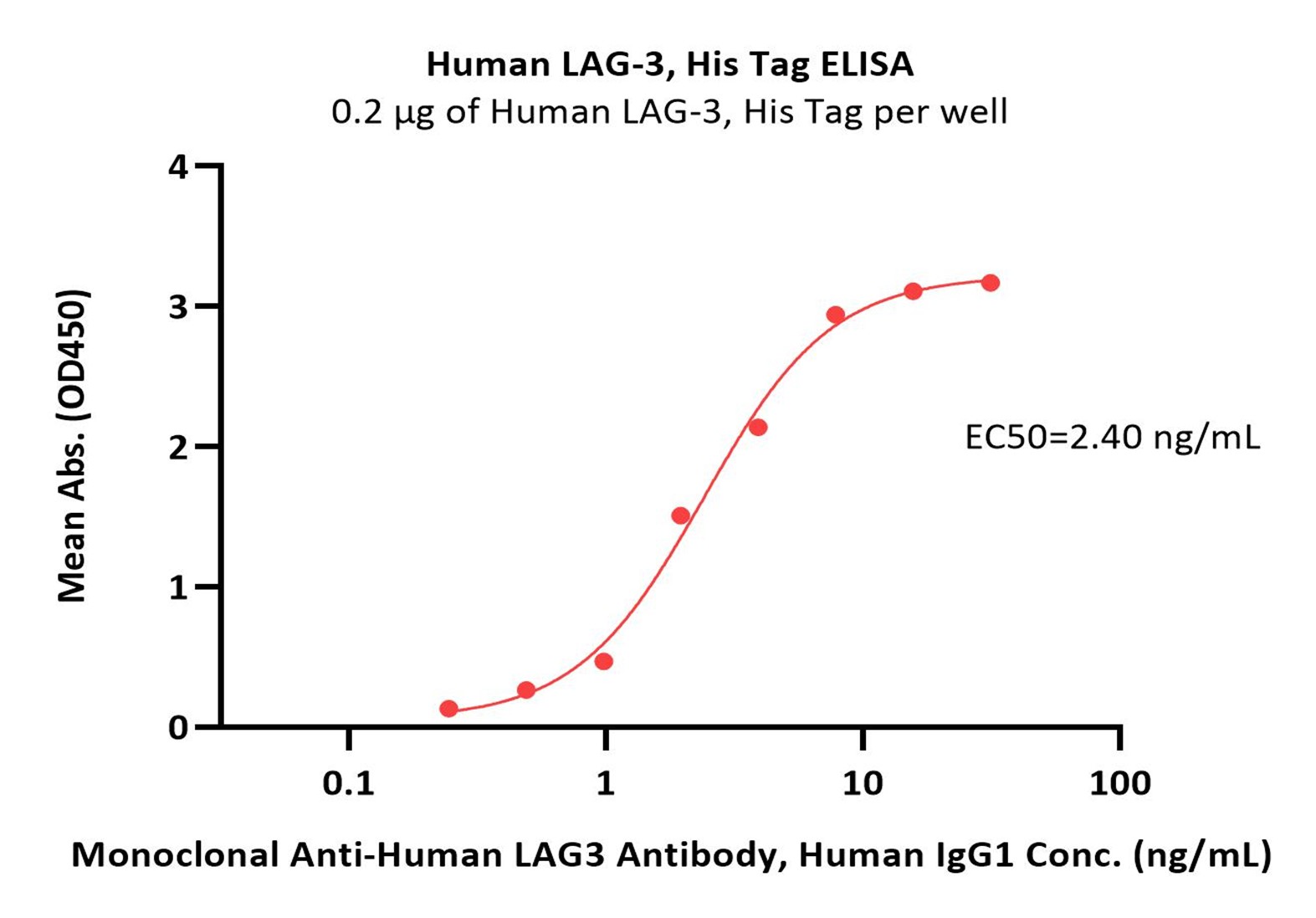
Immobilized Human LAG-3, His Tag (Cat. No. LA3-H5222) at 2 μg/mL (100 μL/well) can bind Monoclonal Anti-Human LAG3 Antibody, Human IgG1 with a linear range of 0.2-4 ng/mL (QC tested).
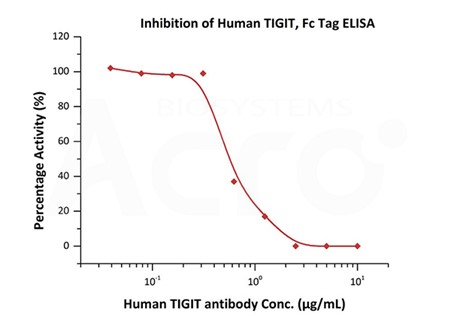
Serial dilutions of Human TIGIT Neutralizing antibody were added into Human TIGIT, Fc Tag (Cat. No. TIT-H5254): Biotinylated Human CD155, Fc,Avitag (Cat. No. CD5-H82F6) binding reactions. The half maximal inhibitory concentration (IC50) is 0.55834 μg/mL (Routinely tested).
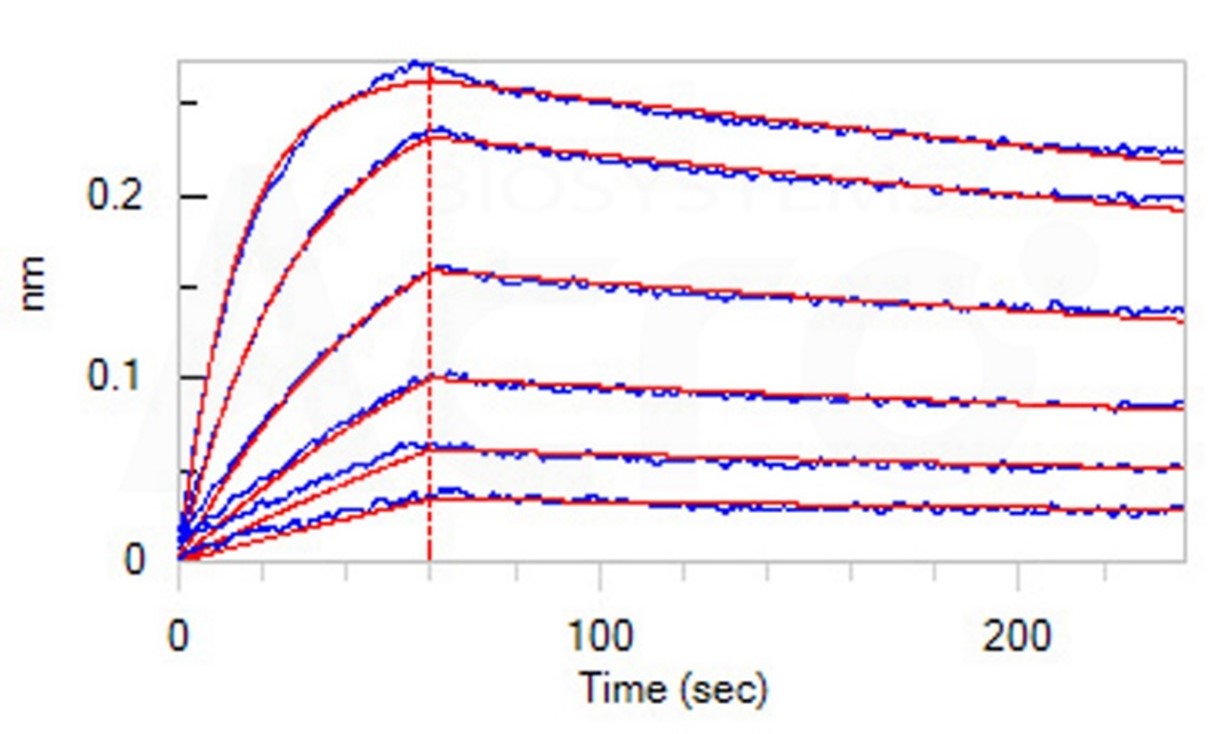
Loaded Anti-OX40 MAb(Human IgG1) on AHC Biosensor, can bind Human OX40 Protein, His Tag (Cat. No. OX0-H5224) with an affinity constant of 6.03 nM as determined in BLI assay (ForteBio Octet Red96e) (Routinely tested).
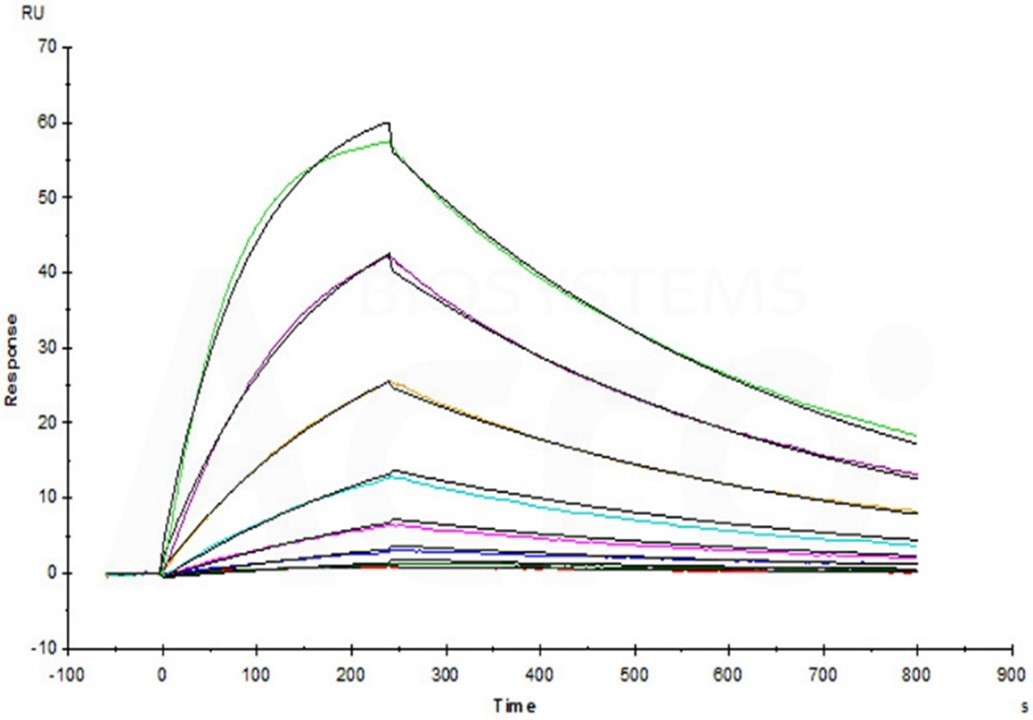
Anti-LAG-3
MAb (Human IgG1) captured on CM5 chip via Anti-Human IgG Fc antibodies
surface, can bind Human LAG-3, His Tag (Cat. No. LA3-H5222) with an affinity constant of 4.57 nM as determined in a SPR assay (Biacore T200) (Routinely tested).
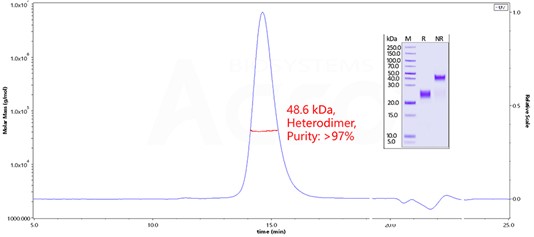
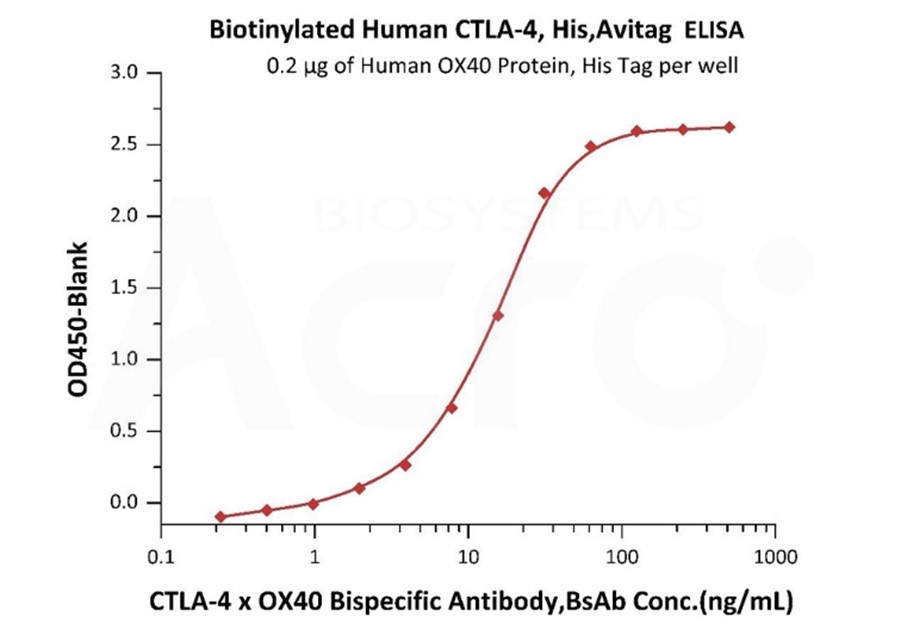
Quantitative Analysis of CTLA-4 x OX40 Bispecific Antibody in Human Serum by Intact Assay.
Immobilized Human OX40 Protein, His Tag (MALS verified) (Cat. No. OX0-H5224) at 2 μg/mL, add increasing concentrations of CTLA-4 x OX40 bispecific antibody in 50% Human serum and then add Biotinylated Human CTLA-4, His, Avitag (Cat. No. CT4-H82E3) at 0.2 μg/mL. Detection was performed using HRP-conjugated streptavidin with sensitivity of 4 ng/mL (Intact assay, Routinely tested).






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining