流式细胞术分析的核心在于“圈门”,所谓“门”和“区域”,是指基于特定特征对细胞群体进行划分,常通过FSC(前向散射)、SSC(侧向散射)及表面标记物来进行“圈门”,以分辨和量化不同的细胞群。本文将将深入探讨流式细胞术中常见的分析图及其解读技巧,特别是如何通过几个简单步骤识别不同荧光标记抗体染色的细胞群。
在进行流式细胞术实验之前,深入了解细胞的基本特性至关重要。准备工作应包括预估细胞的大小和在实验过程中可能发生的变化并准备适当的对照组。尤其是胞内染色时,细胞的固定和渗透过程可能会改变细胞的大小和粒度,从而影响FSC和SSC的测量。同时设置适当的对照组至关重要,如阴性对照可以帮助设定阴性门,确保细胞群数据的准确性。此外,如果细胞有已知标记物,最好将这些标记物包含在染色中,以便更好地识别目标细胞。
圈门的第一步通常是根据细胞的FSC和SSC特性来区分不同的细胞群。FSC反映了细胞的大小,SSC则与细胞的粒度相关。同时这些信号也会受到样本预处理、激光波长、采集角度、折射率以及鞘液的流速等因素的影响。在分析复杂样本(如PBMC外周血单核细胞)时,FSC和SSC的组合有助于区分不同类型的细胞,如淋巴细胞与细胞碎片或死细胞。通过调整阈值,便可以有效排除不相关的细胞群体,如死细胞。
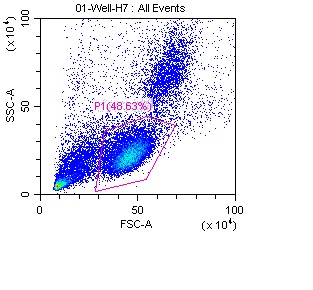
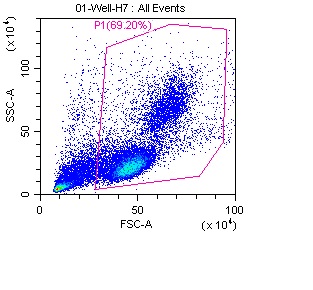
PBMC包含多种不同类型的细胞,如图1中的蓝色、绿色、黄色和红色区域分别代表不同细胞群的数量。通过光散射特性,可以将单核细胞和淋巴细胞从细胞碎片和死细胞中区分开。在图1中,粉色框标示的是淋巴细胞群。细胞碎片和死细胞通常表现出较低的FSC信号,一般位于密度图的左下角区域。为有效排除不相关的细胞,可以通过调整FSC阈值来去除这些细胞,或者通过进一步优化圈门策略,缩小分析范围,如图2所示。这些方法有助于去除由样本中的自身荧光或抗体非特异性结合所引起的背景信号和死细胞。此外,使用死活细胞染料(如DAPI、7-AAD等)也是一种行之有效的手段,可以帮助进一步排除死细胞,确保结果的可靠性。
图1、2中展示的为密度图数据,数据结果也可以以散点图形式展示,或者使用等高线图形式展示。
图1 SSC vs FSC密度图中圈出淋巴细胞(粉色框)。图中每个点代表通过激光器的一个粒子。
图2 SSC vs FSC密度图中排除死细胞及细胞碎片
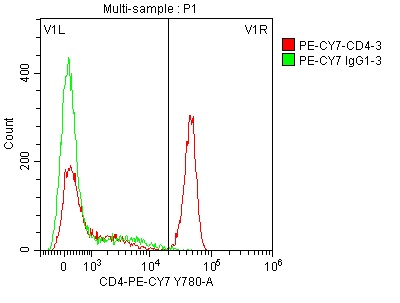
如前所述,可以通过在密度图中设置圈门来排除不感兴趣的细胞群(如细胞碎片)或选择感兴趣的细胞群进行进一步分析(参见图1)。一旦圈定细胞群,接下来便可以使用特定的标记物进行分析。例如,在对PBMC进行CD4(Cat. NO. FABm002-04)染色后,选择淋巴细胞进行分析,并用直方图显示数据。如图3所示,直方图中出现了两个峰,分别对应CD4阳性和CD4阴性细胞。为了准确识别阳性细胞群,排除阴性细胞群,可使用阴性同型对照(isotype control),如图3中绿色的区域代表了同型对照(Cat. NO. FABm008-04),它与CD4阴性细胞群重叠,确保可以准确地识别CD4阳性细胞。
此外,在流式细胞术的分析软件中,还可以进一步分析细胞的百分比、中值荧光强度(MFI)或平均荧光强度(MFI)等数据。
图3 CD4(Cat. NO. FABm002-04)染色的淋巴细胞和同型对照叠加的单参数直方图
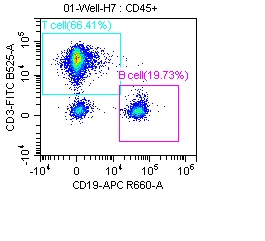
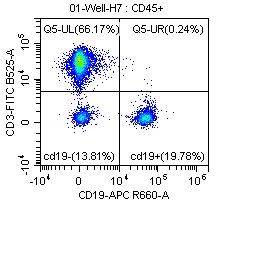
双参数密度图可在x轴和y轴上展示两个不同的参数如FSC、SSC或荧光信号等,常用于区分不同细胞亚群。例如,图4为使用CD3(Cat. NO. FABm001-03)和CD19(Cat. NO. FABm004-02)染色的淋巴细胞,通过圈门策略确定T细胞和B细胞,从图4左图中便可看到T细胞和B细胞的比例分别为66.41%和19.73%。如果把该图显示为四个象限,即可看到单阳性,双阳性和双阴性细胞的比例(右图)。
图4 使用CD3(Cat. NO. FABm001-03)和CD19(Cat. NO. FABm004-02)染色的淋巴细胞的双参数密度图。由FSC和SSC圈定淋巴细胞,确定T细胞与B细胞群比例(左图),通过四象限形式,确定单阳性,双阳性和双阴性细胞的比例(右图)。
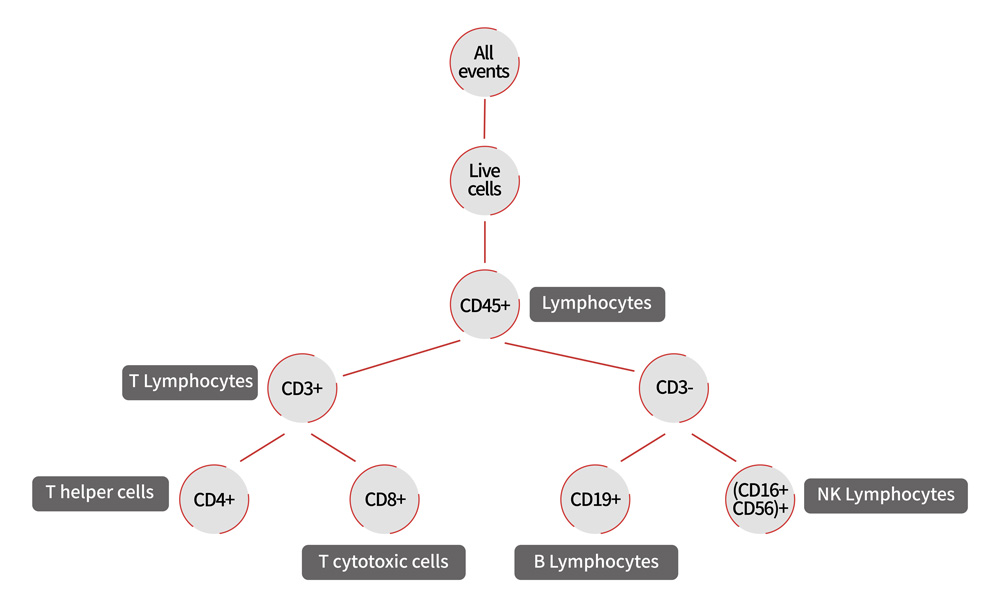
上文介绍的是较为基础的流式细胞仪圈门逻辑,通常在此基础上,实验中会增加更多染色,如TBNK细胞(T细胞、B细胞、NK细胞)群体的染色与分析。我们知道,根据淋巴细胞的发生来源、形态结构、表面标志物及免疫功能不同,淋巴细胞可分为T细胞(CD3+)、B细胞(CD3-CD19+)和NK细胞(CD3-CD16+CD56+)等细胞群,此外,根据CD4和CD8的表达不同,T细胞又分为2个亚群:辅助性T细胞(CD3+CD4+)和杀伤性T细胞(CD3+CD8+)。因此,通过检测细胞表面标志物的表达,可以有效区分并分析不同类型的淋巴细胞亚群比例。
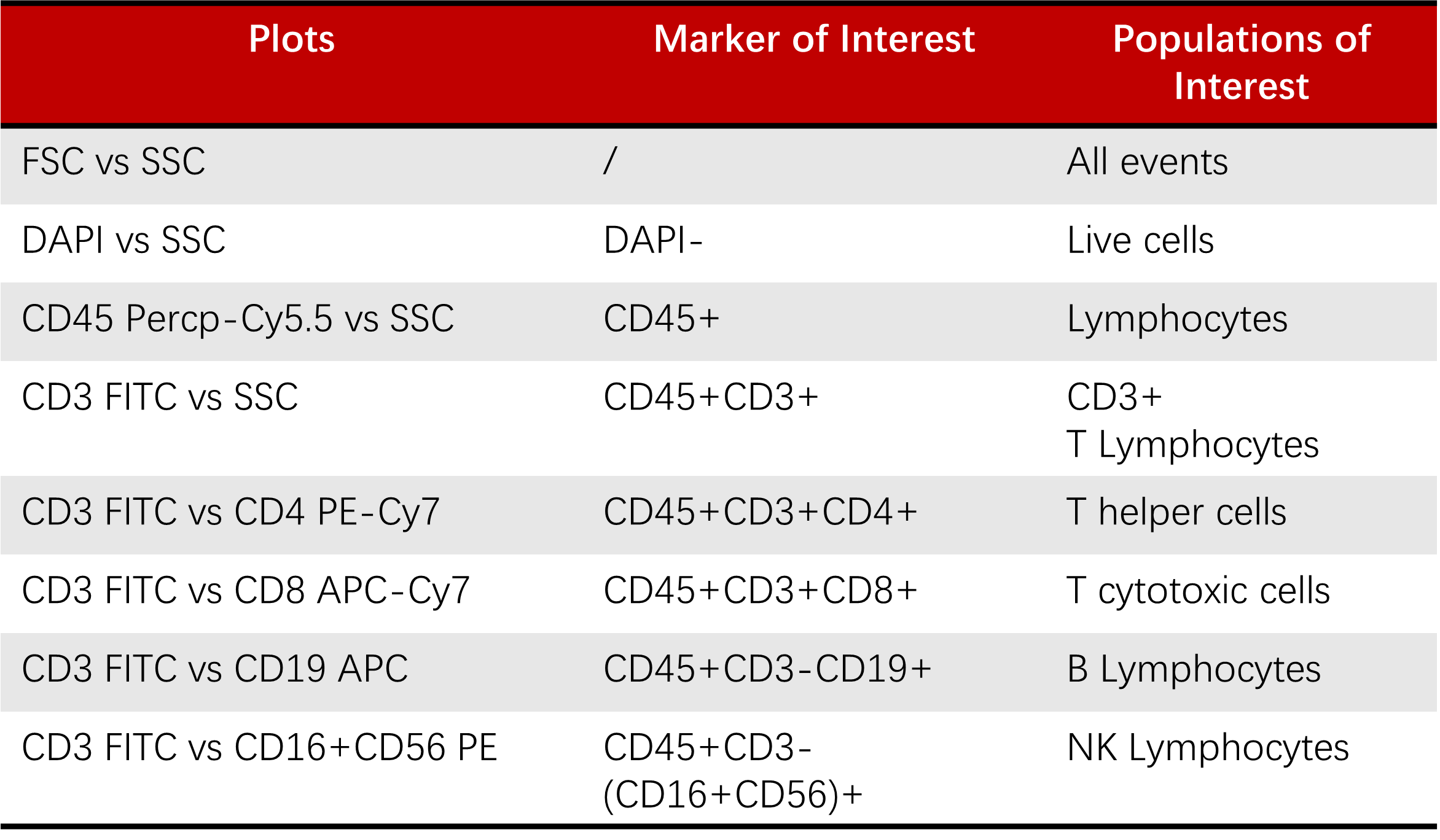
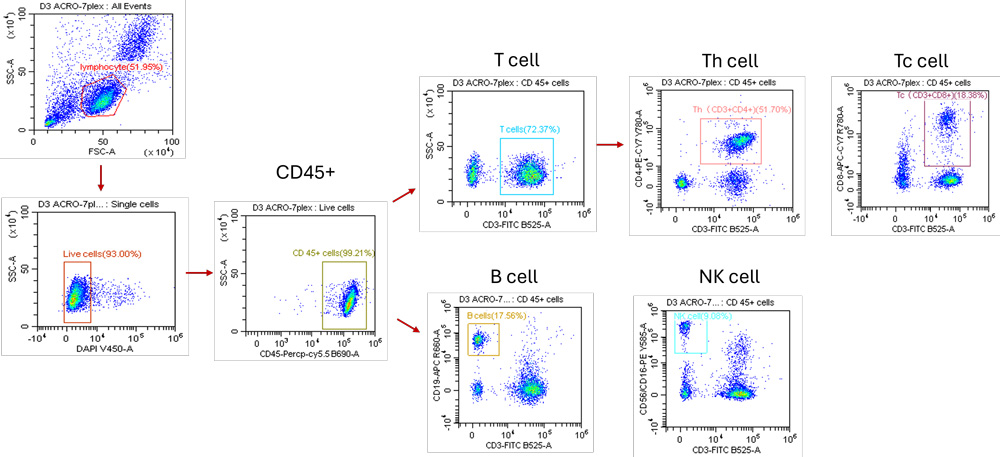
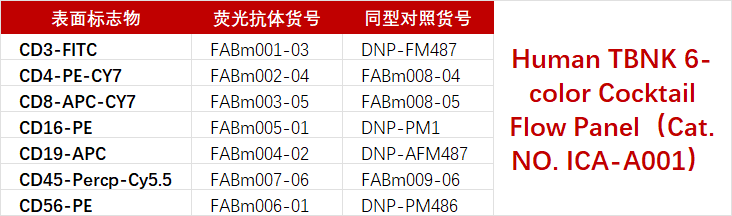
如图5展示的便是使用预混的Human TBNK 6-color Cocktail Flow Panel(Cat. NO. ICA-A001)染色淋巴细胞结果。具体的分析逻辑为:首先利用CD45+选出总淋巴细胞群;然后利用CD3+选出T细胞群,再分别根据CD4+、CD8+得到CD3+CD4+辅助性T细胞和CD3+CD8+细胞毒性T细胞的比例;B细胞、NK细胞的比例则可以分别利用CD3-CD19+、CD3-CD16+CD56+得到。
文末有试剂盒和荧光抗体详细信息,下拉查看~
图5 使用预混Human TBNK 6-color Cocktail Flow Panel(Cat. NO. ICA-A001)染色的淋巴细胞的圈门逻辑
在流式细胞术分析中,细胞群中可能会出现一些表型特殊的亚群,这些细胞常常干扰分析结果。通过对这些特殊细胞亚群的了解,能够有效避免识别错误或分析偏差。例如:
① 少部分NK细胞可表达CD19,在B细胞急性淋巴细胞白血病(B-ALL)的检测中,以CD19设门分析目的细胞群时,这部分CD19+NK细胞容易与目标细胞群混淆,因此必要时可加入NK细胞表面标志物以去除此部分细胞);
② NK细胞可少量表达CD8(比杀伤性T细胞的CD8强度弱),几乎不表达CD4;
③ 表达CD16、CD56同时还表达CD3的淋巴细胞,为自然杀伤性T细胞(NKT细胞)。
流式细胞术在细胞分析和筛选中具有强大的应用价值,通过精确的圈门策略和标志物选择,能够有效识别和分析不同的细胞亚群。随着荧光标记物数量的增加,数据分析的复杂度也随之提升,因此,选择合适的分析工具和对照设置尤为关键。合适的对照组有助于减少背景噪声和非特异性信号的干扰,提高数据的精确性和可靠性;便利的分析工具则简化了实验流程,极大提升了分析效率。通过上述分析技巧和方法的合理应用,可以提高流式细胞术的精确性和可靠性,为科研和临床研究提供有力支持。
ACROBiosystems百普赛斯ClinMax™基于流式细胞术平台,经严格方法学验证,自主研发出即用型Human TBNK 6-color Cocktail Flow Panel(Cat. NO. ICA-A001),可以一次性快速可靠地检测出人全血或PBMC中的T细胞、B细胞和NK细胞群,让您免于配色、多次加样和抗体滴度验证的烦恼,为您在临床前药物开发、临床试验免疫监测等研究提供高质量、高效率的免疫细胞分型分析工具!
荧光抗体全新上线——荧光抗体和试剂盒可灵活选择!






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!































 膜杰作
膜杰作 Star Staining
Star Staining